Izvješće o nuspojavama u 2009. godini
- Uvod
- 1. Ukupan broj prijava
- 2. Prijave nuspojava lijekova i cjepiva
- 2.1. Izvori prijava
- 2.2. Karakteristike prijava nuspojava lijekova i cjepiva
- 2.2.1. Klasifikacija lijekova
- 2.2.2. Dob i spol bolesnika
- 2.2.3. Vrste nuspojava
- 2.2.4. Broj lijekova u istovremenoj primjeni
- 2.2.5. Ozbiljnost nuspojave
- 2.2.6. Ishod nuspojave
- 2.2.7. Stupanj povezanosti nuspojave i lijeka
- 2.2.8. Nuspojave po organskim sustavima
- 2.2.9. Najčešće nuspojave
- 3. Prijave sumnji na ozbiljne neočekivane nuspojave iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
- 4. Zaključak
Uvod
Na temelju Zakona o lijekovima (Narodne novine, br. 71/07. i 45/09.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 125/09.) Agencija za lijekove i medicinske proizvode (u daljnjem tekstu HALMED) prati nuspojave zabilježene u Republici Hrvatskoj, za lijekove koji su u prometu i za lijekove koji se nalaze u kliničkim ispitivanjima, a koje su zdravstveni radnici, nositelji odobrenja za stavljanje gotovog lijeka u promet i nositelji odobrenja za klinička ispitivanja obvezni prijavljivati.
1. Ukupan broj prijava
Tijekom 2009. godine HALMED je zaprimio ukupno 1544 prijave nuspojava u odnosu na 1680 prijava u 2008. godini (Tablica 1). Radi se o manjem padu ukupnog broja prijava od 8% u odnosu na 2008. godinu. Manji broj zaprimljenih prijava je posljedica pada koji je zabilježen u području spontanog prijavljivanja nuspojava cjepiva (vidi odlomak 2: Prijave nuspojava lijekova i cjepiva ovog izvješća).
Broj prijava s područja hemovigilancije koji su ubrojeni u ukupan broj prijava dobiven je na temelju procjene HALMED-a koja se temeljila na broju prijava iz prethodnih godina, a koje su već godinama stabilne. Kako područje hemovigilancije nije u nadležnosti HALMED-a, ovo je posljednje izvješće u kojem je u ukupnom broju prijava uključen i broj prijava iz ovog područja, a za koje je nadležan Hrvatski zavod za transfuzijsku medicinu. Prijave obuhvaćaju prijave na krv i krvne derivate u intenzivnom praćenju, dok se gotovi lijekovi kao što su imunoglobulini prate na nivou HALMED-a u sklopu farmakovigilancije.
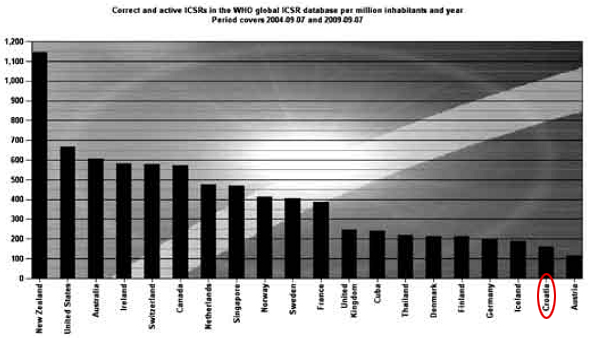
Zahvaljujući zajedničkim naporima HALMED-a i svih zdravstvenih radnika koji redovito prijavljuju sumnje na nuspojave, Republika Hrvatska, po kvaliteti i broju prijava nuspojava, izraženo na milijun stanovnika, nalazi se među prvih 20 od stotinjak zemalja koje sudjeluju u Programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO) s oko 190 kvalitetnih prijava na milijun stanovnika koje se nalaze u svjetskoj bazi nuspojava (VigiBase). Cilj je svakako dostići najmanje 400 kvalitetnih prijava na milijun stanovnika i približiti se Nizozemskoj, Švedskoj, Norveškoj-europskim zemljama s vrlo visokim razvijenim farmakovigilancijskim sustavom, posebno u dijelu spontanog prijavljivanja nuspojava.
Slika 1. preuzeta je iz izvješća Uppsala Monitoring Centre (UMC) - kolaborativnog centra za praćenje nuspojava Svjetske zdravstvene organizacije (WHO) za period 2005. - 2009. (Hrvatska se nalazi na 19. mjestu od 96 zemalja članica Programa).
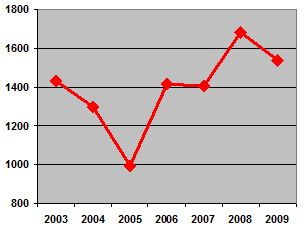
Tablica 1. Kretanje ukupnog broja prijava nuspojava u Republici Hrvatskoj u posljednjih sedam godina (2003. - 2009.)
| Godina | 2003. | 2004. | 2005. | 2006. | 2007. | 2008. | 2009. |
|---|---|---|---|---|---|---|---|
| Broj prijava nuspojava | 1431 | 1300 | 993 | 1415 | 1403 | 1680 | 1544 |
Slika 2. Kretanje broja prijava nuspojava u Republici Hrvatskoj u posljednjih sedam godina (2003.-2009.)
Ukupan broj prijava nuspojava u 2009. godini čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave nuspojava izravno prijavljene HALMED-u od strane zdravstvenih radnika
- nuspojave proslijeđene od nositelja odobrenja za stavljanje lijeka u promet koje su zaprimili od zdravstvenih radnika,
- prijava nuspojava na cjepiva koje zaprima Hrvatski zavod za javno zdravstvo (HZJZ) i prosljeđuje HALMED-u,
- prijava nuspojava cjepiva koje je HALMED izravno primio od zdravstvenih radnika i nositelja odobrenja,
- prijava nuspojava na dodatke prehrani,
- prijava nuspojava izazvanih medicinskim proizvodima,
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR-a) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj,
- prijave iz područja hemovigilancije koju vodi Hrvatski zavod za transfuzijsku medicinu putem Registra transfuzijskih reakcija (intenzivno praćenje nuspojava krvi i krvnih pripravaka).
Broj prijava iz svake od ovih skupina prikazan je u Tablici 2.
Tablica 2. Prijave nuspojava po skupinama proizvoda
| Skupine | Lijekovi (+cjepiva) | Dodaci prehrani | Medicinski proizvodi | Hemovigilancija* | SUSAR** | UKUPNO |
|---|---|---|---|---|---|---|
| Broj prijava | 1165 | 0 | 0 | 350 | 29 | 1544 |
* procjena ukupnog broja posttransfuzijskih reakcija na temelju prijava u 2008. godini
** sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
U 2009. godini HALMED je nastavio održavati radionice za zdravstvene radnike putem kojih ih educira o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj. Održano je ukupno 5 radionica (4 manje u odnosu na 2008. godinu) na kojima je sudjelovalo 55 liječnika, 79 farmaceuta i 54 medicinske sestre što čini ukupno 188 polaznika. Radionice su u 2009. godini održane u Zagrebu i Puli. Svaki polaznik je dobio brošuru s predavanjima, obrasce za prijavljivanje nuspojava i obrazac za prijavljivanje neispravnosti u kakvoći lijeka. U svrhu trajne edukacije, liječnicima se radionica boduje s 4 boda od strane Hrvatske liječničke komore, ljekarnicima s 3 boda od strane Hrvatske ljekarničke komore, a medicinskim sestrama sa 6 bodova od strane Hrvatske komore medicinskih sestara. Od rujna 2005. do kraja 2009. godine HALMED je održao ukupno 75 radionica iz područja farmakovigilancije koje je pohađalo i uspješno završilo gotovo 1400 zdravstvenih radnika.
2. Prijave nuspojava lijekova i cjepiva (1165 prijava)
Od 1165 zaprimljenih prijava, 7 je dobiveno iz objavljenih literaturnih podataka o nuspojavama zabilježenih u Republici Hrvatskoj, 13 prijava je iz neintervencijskih postmarketinških studija, dok je ostalih 1145 prikupljeno spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika izravno HALMED-u ili preko nositelja odobrenja za stavljanje gotovog lijeka u promet.
Promatrajući spontano prijavljene nuspojave dobivene od zdravstvenih radnika, nositelja odobrenja te pred kraj godine i izravno od pacijenata, u 2009. godini prikupljeno je tek 100 prijava manje u odnosu na 2008. godinu kada je bilo zaprimljeno ukupno 1265 prijava. Do pada ukupnog broja prijava došlo je usljed smanjenja broja prijava cjepiva, dok je broj prijavljenih nuspojava na ostale lijekove u porastu. Broj prijava nuspojava cjepiva u 2008. godini u odnosu na broj prijava u 2009. godini iznosio je 654 prema 389, a broj prijava nuspojava za lijekove je u 2008. godini bio 611 prema 776 prijava u 2009. godini.
Porast broja prijava nuspojava na lijekove pokazatelj je veće osviještenosti zdravstvenih radnika o važnosti prijavljivanja nuspojava kao i utjecaj kontinuirane edukacije koje HALMED provodi.
Pad broja prijava nuspojava na području cjepiva rezultat je uspješnog djelovanja HALMED-a u suradnji s Hrvatskim zavodom za javno zdravstvo (HZJZ) koji su poduzeli potrebne regulatorne akcije nakon što su u farmakovigilancijskom sustavu bili identificirani sigurnosni signali na temelju spontanih prijava nuspojava za Cjepivo protiv morbila, rubele i parotitisa i cjepivo Pediacel.
a) Cjepivo protiv morbila, rubele i parotitisa, živo, liofilizirano, Edmonston-Zagreb, HDS; RA 27/3, HDS; L-Zagreb, PF
Značajno je smanjen ukupan broj prijava postvakcinalnih parotitisa nakon cijepljenja cjepivom protiv morbila, rubele i parotitisa (MRP) proizvođača i nositelja odobrenja Imunološkog zavoda, od 228 u 2008. godini na 106 u 2009. godini. Ovaj pad u broju spontanih prijava nuspojava na navedeno cjepivo povezuje se s promjenom u obaveznom kalendaru cijepljenja: odlukom Ministarstva zdravstva i socijalne skrbi (MZSS) cjepivo protiv morbila, rubele i parotitisa, živo, liofilizirano, Edmonston-Zagreb, HDS; RA 27/3, HDS; L-Zagreb, PF, je u travnju 2009. godine zamijenjeno drugim MRP cjepivom odobrenim u Republici Hrvatskoj (Priorix, nositelja odobrenja GSK) u primovakcinaciji djece. Ova promjena u kalendaru cijepljenja temeljila se na preporukama HALMED-a, HZJZ-a i Stručne skupine za ocjenu nuspojava cjepiva HALMED-a i HZJZ-a donesenih uslijed uočenog horizontalnog prijenosa cjepnog soja parotitisa - L-Zagreb od cijepljenje djece na kontakte (najčešće roditelje) koji su oboljeli od parotitisa i od kojih su neki bolesnici razvili i komplikacije kao što su meningitis odnosno orhitis u muškaraca. Uočeno je da je do horizontalnog prijenosa došlo prvenstveno u slučajevima kada se cjepivo primijenilo u primovakcinaciji (vidi: Izvješće o prijavama nuspojava lijekova za 2008. godinu).
U 2008. zabilježena je 31 prijava horizontalnog prijenosa cjepnog soja virusa parotitisa iz Cjepiva protiv morbila, rubele i parotitisa, živo, liofilizirano, Edmonston-Zagreb, HDS; RA 27/3, HDS; L-Zagreb, PF (vidi: Izvješće o prijavama nuspojava lijekova za 2008. godinu), dok u 2009. nije zabilježena niti jedna takva prijava.
U 2009. godini nije zabilježen nijedan slučaj meningitisa uzrokovan MRP cjepivom (odnosno njegovim cjepnim sojem virusa parotitisa), dok je do 2008. godine prosječno bilo zabilježeno oko 18 slučajeva godišnje. Navedeni pad u broju prijava ove nuspojave tumači se kao pozitivna posljedica promjene u kalendaru cijepljenja, u primovakcinaciji.
b) Pediacel
Značajno je smanjen i ukupan broj prijava nuspojava na cjepivo Pediacel, nositelja odobrenja Medoka d.o.o, proizvođača Sanofi Pasteur S.A. U 2008. godini broj prijava je iznosio 236, a u 2009. godini 134 (najčešće se radilo o lokalnim reakcijama na cjepivo) (vidi: Izvješće o prijavama nuspojava lijekova za 2008. godinu), Ovaj pad prijava je također rezultat uspješne komunikacije kako HALMED-a tako i HZJZ-a sa zdravstvenim radnicima i javnošću prema kojima su slane jasne poruke o sigurnosti i reaktogenosti cjepiva koja su u okviru očekivanog.
Ukupno gledajući, 2009. godina je bila s pogleda sigurnosti primjene lijekova vrlo mirna, tek je kraj godine donio pitanja o sigurnosti uporabe antivirusnih lijekova Tamiflu (oseltamivir) i Relenza (zanamivir) te cjepiva protiv novog H1N1 virusa gripe (pandemijska gripa) - Focetria. Intenzivnim praćenjem nuspojava navedenih lijekova i cjepiva kako u Hrvatskoj tako i u Europi i svijetu pokazalo se da je njihov sigurnosni profil pozitivan i da je njihova primjena u indikacijama u kojima su odobreni - vrlo sigurna.
c) Tamiflu, Relenza i Focetria
HALMED je na temelju dostavljene dokumentacije o stabilnosti lijeka odobrio produljenje roka valjanosti lijeku Relenza (zanamivir) s 5 na 7 godina. Za pakovanja lijeka Relenza koja su već u prometu, HALMED je savjetovao čuvanje još dvije godine nakon isteka označenog petogodišnjeg roka valjanosti.
Također, HALMED je prihvatio izmjene u podacima o lijeku Tamiflu (oseltamivir) za sve odobrene farmaceutske oblike i doze na način da se lijek može primjenjivati i za liječenje djece mlađe od 12 mjeseci za vrijeme izbijanja pandemije gripe te za prevenciju gripe u djece mlađe od 12 mjeseci nakon njihovog izlaganja uzročniku gripe tijekom pandemije. Izmijenjeni su podaci o doziranju lijeka obzirom da je odobrena priprema magistralnog oblika lijeka (suspenzije) iz Tamiflu kapsula 30 mg, 45 mg i 75 mg te su navedene i preporuke za doziranje istoga u djece mlađe od godinu dana. U sažetak opisa svojstava lijeka (SPC) i uputu o lijeku (PIL) unesene su i nove informacije o pozitivnom odnosu koristi i rizika primjene lijeka u trudnica i dojilja. Preporučeno je da se lijek oseltamivir u djece mlađe od godinu dana primjenjuje jedino u vrijeme pandemijske gripe.
HALMED se javno očitovao i o sigurnosti primjene cjepiva protiv novog H1N1 virusa gripe (Focetria, nositelja odobrenja Imunološkog zavoda, proizvođača Novartis) i jasno je istaknuto kako je cjepivo sigurno za primjenu.
Zahvaljujući dosadašnjem uspješnom radu u sklopu međunarodnog Programa praćenja nuspojava lijekova Svjetske zdravstvene organizacije kojeg vodi Uppsala Monitoring Center, HALMED je na korištenje, bez naknade, dobio internetsku aplikaciju Paniflow (baza) namijenjenu praćenju sigurnosti primjene cjepiva protiv pandemijske gripe te antivirusnih lijekova Tamiflu i Relenza razvijenu od strane UMC-a i švicarske agencije za lijekove (Swissmedic). Aplikacija omogućava zdravstvenim radnicima da, putem Interneta, izravno prijave nuspojave HALMED-u pomoću elektroničkog obrasca koji se vrlo lako i u kratkom vremenu može ispuniti. Paniflow je namijenjen za korištenje svim zdravstvenim radnicima - cjepiteljima, a zamišljen je upravo za situacije pandemije u kojima se očekuje otežano djelovanje javnih službi, osigurava se na taj način brži protok informacija, a ujedno se pokušava smanjiti kontakt među ljudima u cilju sprječavanja širenja virusa. Ova aplikacija dala je mogućnost HALMED-u da na dnevnoj bazi prati sve prijavljene nuspojave kako na cjepivo tako i na navedene antivirusne lijekove. Nažalost, kako je ukupni odaziv na cijepljenje bio daleko ispod očekivanja (radi se o maksimalno 20 000 cijepljenih osoba u Republici Hrvatskoj), tako je i prijavljivanje putem aplikacije Paniflow bilo slabo i svelo se na sporadične primjere korištenja.
U razdoblju od početka cijepljenja s pandemijskim cjepivom Focetria u Republici Hrvatskoj 27.11.2009. do 30.12.2009. godine primljene su 2 prijave za pacijente u dobnoj skupini od 18 do 64 godine i jedna za pacijenta u dobnoj skupini od 65 do 74 godine. Radi se o ukupno 7 nuspojava koje su sve karakterizirane kao ne-ozbiljne i očekivane:
| Datum prijave | Ozbiljna nuspojava | Prijavitelj | Dob | Dobna skupina | Spol | Ishod | Nuspojava(e) | |
|---|---|---|---|---|---|---|---|---|
| 1. | 03.12.2009. | NE | Liječnik | 58 godina | 18 do 64 godina | Ž | Ozdravljenje | Povišena tjelesna temperatura do 38C, Zimica |
| 2. | 10.12.2009. | NE | Liječnik | 50 godina | 19 do 64 godina | M | U tijeku | Umor, osjetljivost i pečenje kože |
| 3. | 30.12.2009. | NE | Liječnik | 72 godine | 65 do 74 godine | M | U tijeku | Preosjetljivost, osip i svrbež kože |
Sve informacije vezane za ove lijekove i cjepivo objavljene su na internetskoj stranici HALMED-a (Slika 3).
Slika 3. Informacije i aplikacija za prijavu nuspojava pandemijskog cjepiva Focetria i antivirusnih lijekova na internetskoj stranici HALMED-a

Pravilnik o farmakovigilanciji
Krajem 2009. godine na snagu je stupio i novi Pravilnik o farmakovigilanciji (Narodne novine, br. 125/09.) koji je donio značajne promjene na ovom području u Republici Hrvatskoj među kojima ističemo da uz zdravstvene radnike, kojima je to obveza, od stupanja na snagu ovog Pravilnika i pacijenti mogu HALMED-u slati zapažene nuspojave za koje postoji sumnja da su ih izazvali lijekovi koje su koristili.
U daljnjem tekstu analizirane su prijave nuspojava lijekova prikupljene spontanim praćenjem nuspojava od strane zdravstvenih radnika te prijave nuspojava na cjepiva, dakle izuzete su prijave nuspojave iz područja hemovigilancije i kliničkih ispitivanja.
2.1. Izvori prijava
Struktura prijavitelja ponešto je promijenjena u odnosu na onu iz 2008. godine: liječnici specijalisti, ukupno gledajući, i dalje čine najveći dio prijavitelja, pri čemu se broj prijava od strane pedijatara prepolovio (205 u odnosu na 445 iz 2008. godine, odnosno od 338 u 2008. godini iz pedijatrijskih ambulanti na 168 prijava u 2009. godini). Razlog tome je smanjeni broj prijava nuspojava na cjepiva uključenih u obavezni kalendar cijepljenja (vidi: poglavlje 2). Liječnici bez specijalizacije su i tijekom 2009. godine prijavili nešto više od četvrtine nuspojava (27%). Pad broja prijava od strane ljekarnika zaustavljen je u 2009. godini u kojoj je zaprimljeno, iz tog izvora, 225 prijava što čini udio od oko 19% svih prijava nuspojava na lijekove, čime se vraćamo na razinu broja prijava iz 2006. godine. Razloge za ovaj pozitivni pomak u prijavljivanju nuspojava od strane ljekarnika možemo pripisati radu pojedinih vlasnika ljekarni koji su prepoznali da je prijavljivanje nuspojava važan korak u racionalnoj farmakoterapiji i ukupnoj sigurnosti primjene lijekova te u trajnoj edukaciji svojih zaposlenika kako ljekarnika tako i farmaceutskih tehničara. Veliki broj ljekarnika vrlo je pozitivno prihvatio radionice o farmakovigilanciji koje provodi HALMED te je postalo očito da najviše prijavljuju oni farmaceuti koji su prošli takve radionice.
Kao i prethodnih godina, najveći broj prijava HALMED je zaprimio izravno od samih zdravstvenih radnika (666 prijava), a gotovo trećina ukupnog broja (306) stiže posredstvom HZJZ-a koji s epidemiološkog stajališta, zajedno s HALMED-om, prati sigurnost primjene cjepiva koja se nalaze u prometu u Republici Hrvatskoj.
Tijekom 2009. godine HALMED je zaprimio ukupno 192 prijave od strane nositelja odobrenja za stavljanje lijeka u promet, što čini udio od 16,5% ukupnog broja prijava te je u relativnom odnosu više nego prethodne godine.
Po prvi puta u zadnjih pet godina bilježimo jednu prijavu od strane doktora stomatologije.
Stupanjem na snagu novog Pravilnika o farmakovigilanciji u listopadu 2009. godine HALMED je zaprimio i jednu prijavu nuspojave lijeka majke pacijenta.
Tablica 3. Izvori prijava nuspojava lijekova i cjepiva
| Izvor prijave | Broj prijava |
|---|---|
| Liječnik (bez specijalizacije) | 323 |
| Farmaceuti | 225 |
| Psihijatar | 45 |
| Internist (nesp.) | 28 |
| Dermatovenerolog | 23 |
| Pedijatar | 205 |
| Infektolog | 9 |
| Ginekolog | 7 |
| Specijalist obiteljske medicine | 107 |
| Neurolog | 1 |
| Epidemiolog | 18 |
| Specijalist školske medicine | 82 |
| Reumatolog | 2 |
| Onkolog | 5 |
| Fizijatar | 3 |
| Endokrinolog | 1 |
| Gastroenterolog | 1 |
| Klinički farmakolog | 3 |
| Anesteziolog | 3 |
| Nefrolog | 4 |
| Specijalist medicine rada | 1 |
| Transfuziolog | 1 |
| Urolog | 2 |
| Oftalmolog | 1 |
| Ortoped | 1 |
| Otorinolaringolog | 2 |
| SPECIJALISTI UKUPNO: | 555 |
| Stomatolozi | 1 |
| Pacijenti | 1 |
| Nepoznato | 60 |
| UKUPNO PRIJAVA: | 1165 |
Prijavitelji iz bolničkih ustanova sudjelovali su s udjelom od 23% u ukupnom broju prijava što je najveći broj prijava iz tog izvora od početka praćenja spontanih prijava od strane HALMED-a. U odnosu na 2008. godinu kada je zabilježeno 97 prijava iz Kliničkih bolnica i Kliničkih bolničkih centara, u 2009. je zabilježen značajan rast prijava iz navedenih ustanova, čak 163 prijave. Čini se da aktivnosti HALMED-a u senzibilizaciji prijavitelja iz bolničkih ustanova ipak daje rezultate što je i dodatni poticaj da se program edukacije proširi i na ostale bolničke ustanove diljem Hrvatske (Tablica 4). Nuspojave iz bolničkih ustanova su od posebnog značaja jer obično produžuju hospitalizaciju ili dovode do hospitalizacije pa time spadaju u kategoriju ozbiljnih nuspojava.
Tablica 4. Izvori prijava nuspojava lijekova i cjepiva prema ustanovama
| Ustanova | Broj prijava |
|---|---|
| Ordinacije obiteljske medicine | 236 |
| Ljekarne | 223 |
| Klinička bolnica ili Klinički bolnički centar | 163 |
| Psihijatrijska ordinacija | 57 |
| Opće bolnice | 68 |
| Hrvatski zavod za javno zdravstvo | 4 |
| Županijski zavodi za javno zdravstvo | 90 |
| Pedijatrijska ordinacija | 162 |
| Ginekološka ordinacija | 6 |
| Specijalna bolnica | 40 |
| Ordinacija školske medicine | 33 |
| Stomatološka ordinacija | 1 |
| Ostalo | 4 |
| Nepoznato | 75 |
| UKUPNO PRIJAVA: | 1165 |
HALMED je i u 2009. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. U 13 županija zabilježen je pad broja prijava u odnosu na 2008. godinu. Najviše prijava pristiglo je iz područja Grada Zagreba, 355, zatim slijede Primorsko-goranska županija s 91 prijavom, Brodsko-posavska s 86 te Vukovarsko-srijemska s 82 prijave. Najmanje prijava stiglo je iz Ličko-senjske županije, Virovitičko-podravske i Sisačko-moslavačke županije.
Prosječan broj prijava izražen na 10 000 stanovnika za cijelu Republiku Hrvatsku pao je u odnosu na 2008. godinu i iznosi 2,6 prijava (u 2008. iznosio je 2,9 prijava). Prema broju prijava izraženom na 10 000 stanovnika primjetno odskaču Brodsko-posavska, grad Zagreb te Vukovarsko-srijemska županija.
Na temelju ovih podataka HALMED će i dalje planirati održavanje Radionica o ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske.
Tablica 5. Izvori prijava nuspojava lijekova i cjepiva prema županijama (za usporedbu u zagradama su navedeni podaci i iz 2008. i 2007.godine)
| Županija | Broj prijava u 2009. godini | Broj prijava u 2008. godini | Broj prijava u 2007. godini | Broj prijava na 10 000 stanovnika 2009. | Broj prijava na 10 000 stanovnika 2008. | Broj prijava na 10 000 stanovnika 2007. |
|---|---|---|---|---|---|---|
| I. Zagrebačka | 45 | 82 | 26 | 1,5 | 2,6 | 0,8 |
| II. Krapinsko-zagorska | 24 | 29 | 23 | 1,7 | 2,0 | 1,6 |
| III. Sisačko-moslavačka | 8 | 10 | 16 | 0,4 | 0,5 | 0,9 |
| IV. Karlovačka | 18 | 14 | 8 | 1,3 | 1,0 | 0,6 |
| V. Varaždinska | 15 | 27 | 19 | 0,8 | 1,5 | 1,0 |
| VI. Koprivničko-križevačka | 22 | 37 | 61 | 1,8 | 3,1 | 4,9 |
| VII. Bjelovarsko-bilogorska | 28 | 5 | 3 | 2,2 | 0,4 | 0,2 |
| VIII. Primorsko-goranska | 91 | 134 | 69 | 3,0 | 4,5 | 2,3 |
| IX. Ličko-senjska | 4 | 1 | 1 | 0,8 | 0,2 | 0,2 |
| X. Virovitičko-podravska | 5 | 4 | 3 | 0,6 | 0,4 | 0,3 |
| XI. Požeško-slavonska | 14 | 4 | 3 | 1,7 | 0,5 | 0,4 |
| XII. Brodsko-posavska | 86 | 68 | 42 | 4,8 | 3,8 | 2,4 |
| XIII. Zadarska | 36 | 63 | 27 | 2,3 | 4,0 | 1,7 |
| XIV. Osječko-baranjska | 72 | 94 | 83 | 2,2 | 2,8 | 2,5 |
| XV. Šibensko-kninska | 12 | 38 | 5 | 1,0 | 3,5 | 0,4 |
| XVI. Vukovarsko-srijemska | 82 | 85 | 20 | 4,1 | 4,3 | 1,0 |
| XVII. Splitsko-dalmatinska | 75 | 99 | 52 | 1,6 | 2,2 | 1,1 |
| XVIII. Istarska | 70 | 34 | 58 | 3,5 | 1,7 | 2,8 |
| XIX. Dubrovačko-neretvanska | 20 | 42 | 26 | 1,7 | 3,5 | 2,1 |
| XX. Međimurska | 17 | 22 | 18 | 1,4 | 1,8 | 1,5 |
| Grad Zagreb | 355 | 332 | 293 | 4,6 | 4,3 | 3,7 |
| UKUPNO PRIJAVA: | 1099* | 1224 | 856 | 2,6 | 2,9 | 1,4 |
* za 66 prijava nema podataka o tome iz koje je županije prijavitelj
2.2. Karakteristike prijava nuspojava lijekova i cjepiva
Kao i u prethodnoj godini, najviše prijava nuspojava zabilježeno je za lijekove iz skupine J (lijekovi za liječenje sustavnih infekcija). Najveći dio prijava unutar skupine J čine prijave za nuspojave cjepiva, a koja su i prošle godine dominirala nad drugim lijekovima. Ove godine, na drugom mjestu su lijekovi iz skupine N - lijekovi za živčani sustav (gdje vodeće mjesto zauzimaju antipsihotici) za koje je prijavljeno 173 sumnje na nuspojavu i nadmašili su s brojem prijavljenih nuspojava lijekove iz skupine C koji su do sada tradicionalno bili na drugom mjestu. Ukupan broj lijekova na koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava, jer se u jednoj prijavi mogu naznačiti sumnje na nuspojave više lijekova. (Tablica 6).
Tablica 6. Apsolutni broj lijekova za koje je prijavljena sumnja na nuspojave prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji (usporedba s 2008. godinom)
| ATK klasifikacija | Broj prijava | |
|---|---|---|
| 2009. | 2008. | |
| ATK 1. razina A skupina (probavni sustav) | 58 | 56 |
| ATK 1. razina B skupina (učinak na krv) | 35 | 17 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 169 | 145 |
| ATK 1. razina D skupina (dermatici) | 3 | 4 |
| ATK 1. razina G skupina (urogenitalni sustavi spolni hormoni) | 41 | 38 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 8 | 5 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 514 | 775 |
| ATK 1. razina L skupina (citostatici) | 84 | 57 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 51 | 34 |
| ATK 1. razina N skupina (živčani sustav) | 173 | 122 |
| ATK 1. razina P skupina (parazitne infekcije) | 0 | 1 |
| ATK 1. razina R skupina (respiratorni sustav) | 28 | 30 |
| ATK 1. razina S skupina (pripravci za osjetila) | 15 | 8 |
| ATK 1. razina V skupina (različito) | 2 | 3 |
| UKUPNO LJEKOVA: | 1181 | 1295 |
Kako se može uočiti iz tablice 7., najveći pad u broju prijava dolazi iz mlađih dobnih skupina, što se objašnjava padom broja prijava sumnji na nuspojave cjepiva. Za središnje dobne skupine zaprimljeno je više prijava nego 2008. godine.
Tablica 7. Prijave nuspojava i cjepiva prema dobi bolesnika
| Dob bolesnika | Broj prijava u 2009.godini | Broj prijava u 2008.godini |
|---|---|---|
| Do 12 mjeseci | 87 | 131 |
| 1 do 2 godine | 105 | 295 |
| 3 do 6 godina | 90 | 112 |
| 7 do 14 godina | 99 | 104 |
| 15 do 18 godina | 22 | 13 |
| 18 do 40 godina | 164 | 119 |
| 41 do 64 godine | 313 | 237 |
| 65 do 75 godina | 155 | 141 |
| 75 do 85 godina | 80 | 71 |
| Više od 85 godina | 4 | 8 |
| Neupisano | 46 | 34 |
| UKUPNO: | 1165 | 1265 |
Tablica 8. Prijave nuspojava i cjepiva prema spolu bolesnika (usporedba s podacima iz 2007. i 2008. godine)
| Spol | Broj prijava | % ukupnog broja prijava u 2009. godini | % ukupnog broja prijava u 2008. godini | % ukupnog broja prijava u 2007. |
|---|---|---|---|---|
| Muškarci | 457 | 39 | 46,7 | 44,0 |
| Žene | 676 | 58 | 52,3 | 54,0 |
| Nepoznato | 32 | 3 | 1,0 | 2,0 |
| UKUPNO: | 1165 | 100,0 | 100,0 | 100,0 |
U svih pet dosadašnjih izvješća, prijave sumnji na nuspojave većim djelom se prijavljuju za osobe ženskog spola. Tako je bilo i u 2009. gdje je zabilježen porast broja prijava u odnosu na prethodnu godinu.
Nuspojave se osnovno dijele na nuspojave tipa A (posljedica pretjeranog farmakološkog učinka) i nuspojave tipa B u koje spadaju imunoalergijske reakcije, pseudoalergijske reakcije, metabolička intolerancija i idiosinkrazije. Od ukupno 2355 nuspojava, u 358 slučajeva (242 žene i 111 muškaraca) možemo govoriti o reakcijama tipa B. To čini 15% svih prijava, što znači da je u spontanom prijavljivanju zabilježena nešto manja pojavnost od one koja se navodi u literaturnim podacima (oko 25%) (Tablica 9).
Gotovo 70% prijava nuspojava tipa B javila se kod osoba ženskog spola što odgovara literaturnim podacima (oko 65% nuspojava tipa B nastaje kod žena). Kod 3% prijava spol nije bio poznat (Tablica 10).
U nekoliko slučajeva prijava nuspojava tipa F (sumnja na nedjelotvornost lijeka), uslijedila je regulatorna akcija provjere kakvoće proizvoda na koji je takva nuspojava prijavljena.
Tablica 9. Vrste prijavljenih nuspojava u 2009. godini (usporedba s 2008. godinom)
| Vrsta nuspojava | Broj nuspojava 2009. | Broj nuspojava 2008. | % 2009. | % 2008. |
|---|---|---|---|---|
| Tip A | 1981 | 1801 | 84,0 | 81,4 |
| Tip B | 358 | 395 | 15,0 | 17,8 |
| Tip F | 16 | 16 | 1,0 | 0,8 |
| UKUPNO: | 2355 | 2212 | 100,0 | 100,0 |
Tablica 10. Spol i reakcija tipa B u 2009. godini
| Spol | Broj prijava reakcija tipa B | % |
|---|---|---|
| Muškarci | 111 | 31,0 |
| Žene | 242 | 68,0 |
| Nepoznato | 5 | 1,0 |
| UKUPNO: | 2212 | 100,0 |
Tablica 11. Lijek/cjepivo i vrsta nuspojava u 2009. godini
| Vrsta nuspojava | Lijek | Cjepivo | UKUPNO |
|---|---|---|---|
| Tip A | 1408 | 573 | 1981 |
| Tip B | 319 | 39 | 358 |
| Tip F | 14 | 2 | 16 |
| UKUPNO: | 1741 | 614 | 2355 |
2.2.4. Broj lijekova u istovremenoj primjeni
U 2009. godini bilježimo značajan porast broja osoba koji su istovremeno uzimale više lijekova, a dolaze iz dobne skupine 18-40 godina (u usporedbi s izvješćem iz 2008. godine, u 2009. godini gotovo dvostruko više osoba uzimalo je 2 ili 3 lijeka te trostruko više 4 ili 5 lijekova) te 41-64 godina (trostruko više onih koji su uzimali više od 5 lijekova u usporedbi s izvješćem iz 2008. godine). Uzimanje više lijekova istovremeno eksponencijalno povećava mogućnost interakcije između brojnih lijekova, a time i pojave nuspojava koja su posljedica interakcija (Tablica 12 i Slika 4).
Tablica 12. Dob bolesnika i broj lijekova koje bolesnik istovremeno primjenjuje u 2009. godini
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | UKUPNO |
|---|---|---|---|---|---|
| Do 12 mjeseci | 78 | 9 | - | - | 87 |
| 1-2 godine | 102 | 2 | 1 | - | 105 |
| 3-6 godina | 87 | 3 | - | - | 90 |
| 7-14 godina | 92 | 7 | - | - | 99 |
| 15-17 godina | 17 | 3 | 2 | 22 | |
| 18-40 godina | 75 | 64 | 16 | 7 | 164 |
| 41-64 godine | 112 | 101 | 51 | 49 | 313 |
| 65-75 godina | 48 | 37 | 44 | 26 | 155 |
| 75-85 godina | 19 | 26 | 18 | 17 | 80 |
| > 85 godina | 1 | 2 | - | 1 | 4 |
| Neupisano | 32 | 8 | 6 | - | 46 |
| UKUPNO: | 663 | 262 | 138 | 614 | 1165 |
Slika 4. Dob bolesnika i udio lijekova po bolesniku u 2009. godini

U 2009. godini broj nuspojava koje ne ispunjavaju niti jedan od kriterija ozbiljnosti opet je veći od broja ozbiljnih nuspojava. Ipak, omjer 54:46 u korist ne-ozbiljnih nuspojava daleko je od razina zabilježenih u 2007. godini kad je prijavljeno tek nešto više od 25% ozbiljnih nuspojava. Zanimljivo je da je tako visok postotak ozbiljnih nuspojava zabilježen uz vrlo visok postotak prijava od strane farmaceuta - za očekivati bi bilo kako će ta skupina prijavljivati većinom ne-ozbiljne nuspojave.
Postoji nekoliko mogućih objašnjenja ovog stanja:
- Veći broju prijava iz bolničkih ustanova za koje je očekivano kako bi mogli promijeniti odnos ozbiljnih i ne-ozbiljnih nuspojava - ipak se u bolničkim ustanovama zdravstveni radnici susreću s najozbiljnijim nuspojavama.
- Veći broj lijekova u istovremenoj primjeni također bi mogao doprinijeti velikom broju ozbiljnih nuspojava.
- Metodološke promjene koje je HALMED uveo u 2008. godini pri analizi ozbiljnosti nuspojava (smjernice EMA-e vezano za ocjenu ozbiljnosti nuspojava koje spadaju pod MedDRA organski sustav (SOC) Infekcije i infestacije; preporuke Brighton Colaboration Organization, tj. smjernice Svjetske zdravstvene organizacije za ocjenu nuspojava cjepiva).
Kao što se može vidjeti iz tablica 13. i 14., apsolutni broj prijava smrtnih slučajeva kao sumnji na nuspojavu određenog lijeka pao je u odnosu na 2008. godinu, a relativni udio smrtnih slučajeva prepolovljen je u odnosu na 2007. i 2008. godinu.
Tablica 13. Ozbiljnost prijavljenih nuspojava u 2009. u usporedbi s 2008. godinom
| Ozbiljnost nuspojave | Broj prijava u 2009. godini | Broj prijava u 2008. godini | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|
| Ozbiljne | 533 | 641 | 46,0 | 50,7 | 26,0 |
| Ostale | 632 | 624 | 54,0 | 49,3 | 74,0 |
| UKUPNO: | 1165 | 1265 | 100,0 | 100,0 | 100,0 |
Tablica 14. Ozbiljne nuspojave prijavljene u 2009. godini - kriteriji prema ICH smjernici E2A u usporedbi s 2007. i 2008. godinom
| Kriterij | Broj prijava u 2009. godini | Broj prijava u 2008. godini | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|
| Smrt | 10 | 26 | 2,0 | 4 | 4 |
| Hospitalizacija | 110 | 132 | 20,0 | 20 | 41 |
| Invalidnost | 0 | 0 | 0,0 | 0 | 0 |
| Ugrožava život | 25 | 33 | 4,5 | 5 | 14 |
| Prirođena anomalija | 2 | 0 | 0,5 | 0 | 0 |
| Medicinski značajno ozbiljno stanje | 402 | 461 | 73,0 | 71 | 37 |
| UKUPNO: | 549* | 652 | 100,0 | 100,0 | 100,0 |
* neke nuspojave ispunjavaju nekoliko kriterija ozbiljnosti pa je ukupan zbroj u tablici 14. veći od ukupno broja prijava ozbiljnih nuspojava
U 2009. godini zabilježen je 5% veći broj prijava u kojima su se pacijenti potpuno oporavili od nuspojave u odnosu na 2008. godinu. Ponovila se situacija iz 2008. godina kada u velikom zaprimljenih prijava nije naveden ishod nuspojave. Kao i u slučaju ocjene povezanosti od strane prijavitelja, HALMED je promijenio izgled obrasca kako bi se prijaviteljima olakšalo označavanje ishoda nuspojave (Tablica 15).
Broj smrtnih ishoda je usprkos činjenici većeg broja prijava iz bolničkih ustanova i općenito velikom broju ozbiljnih nuspojava pao u apsolutnom i relativnom iznosu - postotak je upola manji u odnosu na 2007. i 2008. godinu.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u deset bolesnika.
Lijekovi za koje se sumnja da su uzrokovali nuspojave koje su povezane sa smrtnim ishodom spadaju u grupu psiholeptika N05 (3 prijave), pripravke za liječenje bolesti kostiju M05 (2 prijave), grupu antiepileptika N03 (1 prijava), lijekove za liječenje poremećaja kiselosti A02 (1 prijava), grupu antineoplastika L01 (1 prijava), grupu imunostimulatora L03 (1 prijava) i blokatore beta adrenergičnih receptora C07 (1 prijava).
8 prijava dobiveno je od zdravstvenih radnika u vidu spontane prijave, dok su dvije prijave zabilježene iz literature.
U navedenih 10 prijava sumnji na smrtni ishod, niti u jednom slučaju nije utvrđena sigurna povezanost između primjene lijeka i smrtnog ishoda. U jednom slučaju smrtni ishod se ne može izravno povezati s nuspojavama koje je lijek izazvao (bol u epigastriju i proljevaste stolice) već su nuspojave mogle pogoršati tijek osnovne bolesti (bolesnik je bolovao od insuficijencije srca i karcinoma pluća). U dva slučaja simptomi koji su uočeni kod pacijenta (infarkt miokarda i karcinom pluća) vjerojatno nisu posljedica uzimanja lijeka, a u ostalih 7 prijava simptomi koje su razvili pacijenti ocijenjeni su kao moguće nuspojave lijekova. Nuspojave koje su dovele do smrtnog ishoda bile su somnolencija, demencija, skok iz zgrade (samoubojstvo), septički šok, respiratorna insuficijencija, toksična generalizirana epidermioliza s akutnim zatajenjem bubrega. U jednog bolesnika ustanovljena je iznenadna smrt.
Tablica 15. Ishod nuspojava lijekova i cjepiva prijavljenih u 2009. godini
| Ishod nuspojave | Broj prijava | Postotak (%) u 2009. | Postotak (%) u 2008. |
|---|---|---|---|
| Oporavak bez posljedica | 1392 | 59,0 | 54,2 |
| Oporavak s posljedicama | 11 | 0,5 | 0,3 |
| U tijeku | 130 | 5,5 | 20,0 |
| Bez oporavka/Nepoznato | 798 | 34,0 | 23,5 |
| UKUPNO: | 2331 | 100,0 | 100,0 |
2.2.7. Stupanj povezanosti nuspojave i lijeka
Za ocjenu povezanosti upotrijebljena je Klasifikacija Svjetske zdravstvene organizacije (WHO) koja je modificirana procjena povezanosti prema Karch-Lasagna-i. Nešto više od trećine prijava pristiglih u HALMED nije imalo ocjenu povezanosti primjene lijeka i nuspojave od strane prijavitelja (Tablica 16). Kako je kroz prošla dva izvješća naglašavano, ovaj problem moguće je riješiti boljim dizajnom obrasca,: zbog toga je HALMED, nakon stupanja na snagu novog Pravilnika o farmakovigilanciji, pripremio novi izgled obrasca za kojeg se pretpostavlja kako će biti dovoljno intuitivan i prijavitelje navesti da daju svoju ocjenu povezanosti nuspojave i lijeka. Kao i u prošlom izvješću, u ocjeni Agencije dominira "vjerojatna" povezanost primjene lijeka i nuspojave što znači da je u najvećem broju slučajeva postojao podatak o nestanku nuspojave nakon prekida davanja lijeka (pozitivan dechallenge), bez podataka o ponovnoj pojavi nuspojave kod ponovnog davanja lijeka (negativan rechallenge), što je kriterij za sigurnu povezanost.
Tablica 16. Povezanost primjene lijeka i nuspojave prema ocjeni prijavitelja i HALMED-a
| Povezanost lijeka i nuspojave | Prijavitelj | HALMED |
|---|---|---|
| Sigurna | 29 | 88 |
| Vjerojatna | 531 | 669 |
| Moguća | 168 | 380 |
| Nije vjerojatna | 11 | 26 |
| Nije moguće klasificirati | 22 | 2 |
| Nedostaje procjena | 404 | - |
| UKUPNO: | 1165 | 1165 |
2.2.8. Nuspojave po organskim sustavima
Nuspojave su navedene prema Medicinskom rječniku za regulatorne poslove -MedDRA-inoj klasifikaciji organskih sustava prema kojima se šifriraju prijavljene nuspojave (MedDRA - Medical Dictionary for Regulatory Activities).
U 2009. godini najveći broj nuspojava zabilježen je kod SOC-a Opći poremećaji i reakcije na mjestu primjene (23,2%), slijede Poremećaji probavnog sustava (14,5%) te Poremećaji kože i potkožnog tkiva i Poremećaji živčanog sustava sa jednakim postotkom od 12,1 %. Agencija je zaprimila tri prijave za SOC-eve Prirođeni, obiteljski i genetski poremećaji i Endokrini poremećaji, po dvije prijave za SOC Operativni i medicinski postupci, Dobroćudne, zloćudne i nespecificirane novotvorine te SOC Socijalne okolnosti, a za SOC Stanja vezana uz trudnoću, babinje i perinatalno razdoblje tek jednu prijavu (Tablica 17).
Podaci ukazuju na to da je potreban daljnji edukacijski rad Agencije prema zdravstvenim radnicima kako bi se prijavile sve sumnje na nuspojave iz područja genetskih poremećaja i malformacija, jer su ti podaci od iznimnog značenja za sigurnost primjene lijekova u trudnoći.
Tablica 17. Nuspojave po MedDRA-inoj klasifikaciji organskih sustava u 2009. godini u usporedbi s udjelom u 2008. i 2007. godini
| Organski sustav (SOC) | Broj nuspojava u 2009. | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 25 | 1,1 | 1,8 | 1,7 |
| II. Srčani poremećaji | 43 | 1,8 | 1,4 | 1,5 |
| III. Prirođeni, obiteljski i genetski poremećaji | 3 | 0,1 | 0,0 | 0,2 |
| IV. Poremećaji uha i labirinta | 30 | 1,3 | 1,0 | 1,2 |
| V. Endokrini poremećaji | 3 | 0,1 | 0,1 | 0,2 |
| VI. Poremećaji oka | 60 | 0,5 | 2,7 | 2,7 |
| VII. Poremećaji probavnog sustava | 341 | 14,5 | 12,7 | 19,1 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 547 | 23,2 | 27,7 | 17,2 |
| IX. Poremećaji jetre i žuči | 14 | 0,6 | 0,5 | 0,3 |
| X. Poremećaji imunološkog sustava | 14 | 0,6 | 1,1 | 1,8 |
| XI. Infekcije i infestacije | 142 | 6,0 | 14,7 | 5,8 |
| XII. Pretrage | 102 | 4,3 | 3,6 | 3,2 |
| XIII. Ozljede, trovanja i proceduralne komplikacije | 16 | 0,7 | 0,4 | 0,0 |
| XIV. Poremećaji metabolizma i prehrane | 22 | 0,9 | 0,7 | 1,3 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 107 | 4,5 | 2,7 | 3,5 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 2 | 0,1 | 0,1 | 0,3 |
| XVII. Poremećaji živčanog sustava | 286 | 12,1 | 8,0 | 10,0 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 1 | 0,0 | 0,1 | 0,3 |
| XIX. Psihijatrijski poremećaji | 120 | 5,1 | 3,0 | 3,5 |
| XX. Poremećaji bubrega i mokraćnog sustava | 20 | 0,8 | 1,0 | 0,9 |
| XXI. Poremećaji reproduktivnog sustava i dojki | 25 | 1,1 | 0,6 | 1,3 |
| XXII. Poremećaji dišnog sustava, prsišta i sredoprsja | 92 | 3,9 | 3,7 | 4,4 |
| XXIII. Poremećaji kože i potkožnog tkiva | 285 | 12,1 | 10,8 | 18,5 |
| XXIV. Socijalne okolnosti | 2 | 0,1 | 0,1 | 0,1 |
| XXV. Operativni i medicinski postupci | 2 | 0,1 | 0,0 | 0,0 |
| XXVI. Krvožilni poremećaji | 51 | 2,2 | 1,6 | 0,9 |
| UKUPNO: | 2355 | 100,0 | 100,0 | 100,0 |
Tablica 18. Najčešće prijavljene nuspojave po prijavama nuspojava za cjepiva i lijekove u 2009. godini
| Nuspojava | Broj prijava |
|---|---|
| Parotitis | 106 |
| Mučnina | 75 |
| Lokalna reakcija | 75 |
| Povišena tjelesna temperatura | 71 |
| Opsežna oteklina cijepljenog uda | 69 |
| Glavobolja | 56 |
| Svrbež | 47 |
| Proljev | 45 |
| Povraćanje | 44 |
| Urtikarija | 36 |
| Astenia | 32 |
| Bol u mišićima | 31 |
| Osip | 29 |
| Crvenilo | 29 |
| Periferni otok | 28 |
| Kašalj | 25 |
| Umor | 24 |
| Somnolencija | 21 |
| Omaglica | 21 |
| Nesanica | 21 |
| Bol u trbuhu | 21 |
3. Prijave sumnji na ozbiljne neočekivane nuspojave iz kliničkih ispitivanja koje se provode u Republici Hrvatskoj
Sigurnosne informacije o pojedinačnim nuspojavama iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj naručitelji ispitivanja su dužni dostavljati ako se nastala nuspojava od strane ispitivača i naručitelja ocijeni kao ozbiljna i neočekivana. Takva se nuspojava zove SUSAR i mora se prijaviti žurno u roku 7 dana od saznavanja informacije, odnosno narednih 15 dana od saznavanja dodatnih informacija. U 2009. godini prijavljeno je 29 SUSAR-a, a radilo se o lijekovima koji se ispituju u indikacijama shizofrenija, epilepsija, karcinom dojke ili prevencija prijeloma kod osteoporoze, kronična limfatična leukemija i multipla skleroza. Niti jedan od prijavljenih slučajeva nije imao fatalni ishod, a ozbiljnost se u većini slučajeva temeljila na hospitalizaciji ili produljenu postojeće hospitalizacije.
4. Zaključak
- Broj spontanih prijava pao je za 8% u odnosu na 2008. godinu (1165 prijava prema 1265 iz 2008. godine), što je posljedica značajnog pada prijava ozbiljnih nuspojava na Cjepivo protiv morbila, rubele i parotitisa te Cjepiva protiv difterije, tetanusa, pertusisa (nestanično, peterokomponentno), poliomijelitisa (inaktivirano) i Haemofilusa influence tip b, a što je povezano s provedenim regulatornim sigurnosnim akcijama.
- Najveći broj prijavitelja u 2009. čine liječnici specijalisti, iako je broj prijava koje je HALMED zaprimio od pedijatara prepolovljen s obzirom da su pedijatri u 2008. godini prvenstveno prijavljivali nuspojave na cjepiva koja su se tada nalazila u kalendaru cijepljenja, a u 2009. godini su zamijenjena drugim cjepivom.
- Ukupni udio prijava od strane ljekarnika značajno je porastao na 19% svih prijava u odnosu na 2008. godinu kada je taj udio iznosio svega 7%. Ovaj rast se može objasniti i internim stimulacijama ljekarni prema svojim zaposlenim farmaceutima i provođenje mjera za racionalnu potrošnju lijekova putem kontinuirane edukacije.
- Udio prijava dobivenih od nositelja odobrenja za stavljanje lijeka u promet iznosi 16,5%, i tu se također uočava konstantni uzlazni trend kada se uspoređuju podaci od 2005. godine do danas.
- Broj prijava iz bolničkih ustanova najveći je od početka praćenja spontanih prijava od strane HALMED-a. Poznato je da se najviše ozbiljnih nuspojava bilježi kod hospitaliziranih bolesnika te je potrebno i dalje poticati prijavljivanje uočenih nuspojava iz bolničkih ustanova.
- Broj prijava sumnji na ozbiljne nuspojave lijekova/cjepiva je manji u odnosu na 2008. godinu od ne-ozbiljnih nuspojava.
- Najviše nuspojava je prijavljeno na lijekove iz skupine J (antibiotici i cjepiva), a na drugom mjestu u 2009. godini nalaze se nuspojave lijekova iz skupine N (živčani sustav). Na trećem mjestu nalaze se lijekovi iz skupine C (kardiovaskularni lijekovi) koji su i najpropisivaniji lijekovi u Republici Hrvatskoj.
- Po organskim sustavima nuspojave najviše pripadaju skupini "Općim poremećajima i reakcijama na mjestu primjene", a slijede ih nuspojave is skupina: "Poremećaji probavnog sustava", "Poremećaji živčanog sustava" i "Poremećaji kože i potkožnog tkiva".





