Izvješće o nuspojavama u 2010. godini
- Uvod
- 1. Prijave nuspojava
- 1.1. Izvori prijava
- 1.2. Karakteristike prijava nuspojava lijekova i cjepiva
- 1.2.1. Klasifikacija lijekova
- 1.2.2. Dob i spol bolesnika
- 1.2.3. Vrste nuspojava
- 1.2.4. Broj lijekova u istovremenoj primjeni
- 1.2.5. Ozbiljnost nuspojave
- 1.2.6. Ishod nuspojave
- 1.2.7. Stupanj povezanosti nuspojave i lijeka
- 1.2.8. Nuspojave po organskim sustavima
- 1.2.9. Najčešće prijavljene nuspojave u 2010.
- 2. Pregled sigurnosnih pitanja iz 2010. godine
- 2.1. Rosiglitazon
- 2.2. Sibutramin
- 2.3. Klopidogrel i omeprazol/esomeprazol
- 2.4. Ketoprofen (oblici za lokalnu primjenu)
- 2.5. Vorikonazol
- 2.6. Cjepivo protiv rotavirusa
- 2.7. Bufeksamak
- 2.8. Humani imunoglobulin (Octagam)
- 2.9. Bevacizumab
- 2.10. Otopine za peritonejsku dijalizu
- 2.11. Rivastigmin
- 2.12. Izotretionin
- 2.13. Tocilizumab
- 2.14. Sunitinib
- 2.15. Aprotinin
Uvod
Na temelju Zakona o lijekovima (Narodne novine, br. 71/07. i 45/09.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 125/09.) Agencija za lijekove i medicinske proizvode - HALMED (u daljnjem tekstu HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje gotovog lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave nuspojava lijekova od pacijenata. HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je šesto (6.) izvješće o prijavama nuspojava zaprimljenim iz Republike Hrvatske koje je izradio HALMED.
1. Prijave nuspojava
Tijekom 2010. godine HALMED je zaprimio ukupno 1338 prijava nuspojava u Republici Hrvatskoj.
Ukupan broj prijava nuspojava u 2010. godini u Republici Hrvatskoj čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave nuspojava izravno prijavljene HALMED-u od strane zdravstvenih radnika
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje gotovog lijeka u promet koje su zaprimili od zdravstvenih radnika ili pacijenata,
- prijave nuspojava izravno prijavljene HALMED-u od strane pacijenata/korisnika lijeka
- spontanih prijava nuspojava cjepiva zaprimljenih u HALMED-u:
-
- prijava nuspojava na cjepiva koje zaprima Hrvatski zavod za javno zdravstvo (HZJZ) i prosljeđuje HALMED-u,
- prijava nuspojava cjepiva koje je HALMED izravno primio od zdravstvenih radnika ili nositelja odobrenja,
- prijava nuspojava dodataka prehrani,
- prijava nuspojava izazvanih medicinskim proizvodima,
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR-a) iz kliničkih ispitivanja koje se provode u Republici Hrvatskoj
Broj prijava iz svake od ovih skupina prikazan je u Tablici 1, a njihov udio na Slici 1.
Tablica 1. Prijave nuspojava po skupinama proizvoda (ukupan broj)
| Skupine | Lijekovi | Cjepiva | Dodaci prehrani | Medicinski proizvodi | SUSAR* | UKUPNO |
|---|---|---|---|---|---|---|
| Broj prijava | 983 | 331 | 5 | 3 | 16 | 1338 |
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koje se provode u Republici Hrvatskoj
Slika 1. Udio prijava nuspojava po skupinama proizvoda

*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koje se provode u Republici Hrvatskoj
U daljnjem tekstu analizirane su prijave nuspojava lijekova prikupljene spontanim praćenjem nuspojava od strane zdravstvenih radnika te prijave nuspojava na cjepiva, dakle izuzete su prijave nuspojava iz područja kliničkih ispitivanja (SUSAR). Naglašavamo da se ovo izvješće razlikuje od prethodnih, jer su u ukupnom broju prijava izostavljene prijave iz područja hemovigilancije, koja nije u nadležnosti HALMED-a.
Od 1322 zaprimljenih spontanih prijava, 40 je dobiveno iz objavljenih literaturnih podataka o nuspojavama zabilježenih u Republici Hrvatskoj, 37 prijava je iz neintervencijskih postmarketinških studija, dok je 1238 prikupljeno spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika izravno HALMED-u ili preko nositelja odobrenja za stavljanje gotovog lijeka u promet te 7 od pacijenata/korisnika lijeka koji su nuspojavu prijavili izravno HALMED-u.
Ključni zaključci razmatranja dobivenih podataka su sljedeći:
- Broj spontanih prijava porastao je za 13,5% u odnosu na 2009. godinu (1322 prijava prema 1165 iz 2009. godine).
- Najveći broj prijavljivača u 2010. i dalje čine liječnici specijalisti.
- Broj prijava od strane ljekarnika ostao je stabilan (20% u 2010. godini u odnosu na 19% u 2009. godine) i čini značajan udio u ukupnom broju prijava.
- Udio broja izravnih prijava od strane pacijenata/korisnika lijeka i dalje ostaje izuzetno mali (0,53%), slično kao i u 2009. godini od kada HALMED i prihvaća ovaj način prijave.
- Broj prijava dobivenih od nositelja odobrenja iznosi 25%, što je do sada najveći udio prijava od nositelja zabilježen u dosadašnjim izvješćima.
- Najveći broj prijava dolazi iz primarne zdravstvene skrbi.
- Broj prijava sumnji na nuspojave lijekova koje ocjenjujemo kao ozbiljne nuspojave veći je od onih koje ne ispunjavaju niti jedan od kriterija ozbiljnosti.
U 2010. godini zabilježen je porast broja prijava nuspojava na lijekove što je rezultat intenzivnog rada HALMED-a na edukaciji i izravnom informiranju zdravstvenih radnika te nositelja odobrenja za stavljanje gotovog lijeka u promet o važnosti prijavljivanja nuspojava kao i njihovoj ulozi u procjeni sigurnosnog profila lijekova. Zahvaljujući tome stvorena je stabilna osnovica određenog broja prijavitelja.
Analizom prijava iz prvog polugodišta 2011. godine, uočava se da će broj prijava nastaviti rasti i u 2011. godini. Tako je u prvih šest mjeseci prikupljeno 1030 prijava sumnji na nuspojave u odnosu na 579 prijava prikupljenih u istom razdoblju u 2010. godini (porast od 78%). Porast prvenstveno pripisujemo prijavama iz tzv. poticanog prijavljivanja kroz osvješćivanje važnosti prijavljivanja nuspojava, osobito za lijekove kojima se putem farmakogenomske analize može individualizirati terapija i time osigurati najsigurniju primjenu lijeka u kroničnoj terapiji bolesnika bez razvoja ozbiljnih i teških nuspojava (npr. za lijekove kao što su varfarin, statini i sl.).
Važno je naglasiti da opći porast broja prijava ne znači nužno problem s kakvoćom, djelotvornošću ili sigurnošću primjene lijekova. Dapače, svaka dodatna prijava znači dodatnu informaciju o lijeku za korisnike lijeka i zdravstvene radnike. Problem predstavlja tek kad je stopa prijavljivanja za određenu kombinaciju lijek - nuspojava značajno viša od očekivane. Generiranjem signala HALMED takve slučajeve može na vrijeme uočiti i na vrijeme poduzeti sve potrebne regulatorne akcije koje uključuju izmjenu podataka o lijeku, informiranje zdravstvenih radnika, pacijenata, javnosti te ako je potrebno donosi odluku o privremenom ili trajnom ukidanju odobrenja za stavljanje u promet.
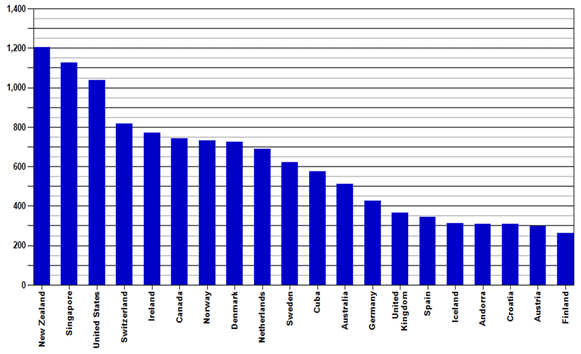
Zahvaljujući zajedničkim naporima HALMED-a i svih zdravstvenih radnika koji redovito prijavljuju sumnje na nuspojave, Republika Hrvatska se, po kvaliteti i broju prijava nuspojava, izraženo na milijun stanovnika, nalazi na visokom 18 mjestu od 106 zemalja, članica Programa praćenja sigurnosti lijekova Svjetske zdravstvene organizacije.
Slika 2. preuzeta je sa internetske stranice Uppsala Monitoring Centra (UMC) - centra za praćenje nuspojava Svjetske zdravstvene organizacije (SZO) za razdoblje travanj 2006. - ožujak 2011. godine (http://www.who-umc.org/).
Slika 2. Broj prijava nuspojava na milijun stanovnika u bazi Svjetske zdravstvene organizacije (Uppsala Monitoring Centre - VigiBase), travanj 2006. - ožujak 2011. godine
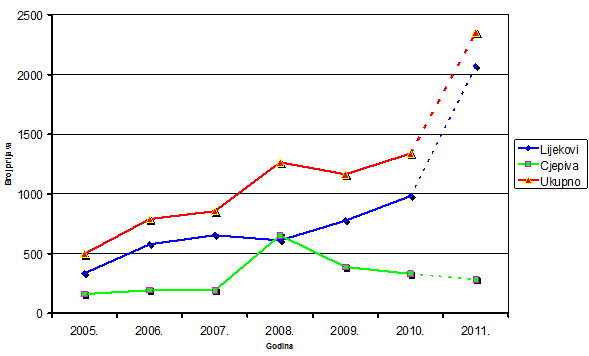
Tablica 2. Kretanje ukupnog broja prijava nuspojava u Republici Hrvatskoj u posljednjih šest godina (2005.-2010.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. |
|---|---|---|---|---|---|---|
| Ukupan broj prijava nuspojava | 498 | 790 | 856 | 1265 | 1165 | 1338 |
Tablica 3. Kretanje broja prijava nuspojava na lijekove i cjepiva u Republici Hrvatskoj u posljednjih šest godina (2005.-2010.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. |
|---|---|---|---|---|---|---|
| Lijekovi | 336 | 579 | 655 | 611 | 776 | 983 |
| Cjepiva | 162 | 194 | 192 | 654 | 389 | 331 |
Slika 3. Kretanje broja prijava nuspojava u Republici Hrvatskoj u posljednjih šest godina (2005.-2010.) i predviđanje ukupnog broja zaprimljenih prijava do kraja 2011. godine
U 2010. godini HALMED je nastavio održavati radionice za zdravstvene radnike i odgovorne osobe za farmakovigilanciju nositelja odobrenja putem kojih ih educira o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj. Održane su 4 radionice na kojima je sudjelovalo ukupno 19 liječnika, 32 farmaceuta, 3 diplomirana inženjera biokemije i po 1 doktor veterinarske medicine i doktor stomatologije što čini ukupno 56 polaznika. Od rujna 2005. do kraja 2010. godine HALMED je održao ukupno 80 radionica na području cijele Republike Hrvatske iz područja farmakovigilancije koje je pohađalo i uspješno završilo više od 1400 zdravstvenih radnika.
1.1. Izvori prijava
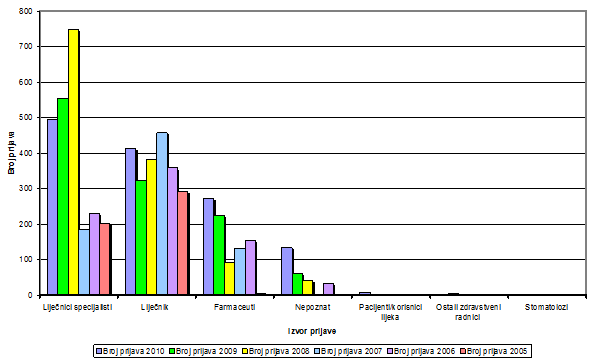
Liječnici specijalisti i dalje čine najveći dio prijavitelja, pri čemu je broj prijava od strane specijalista pedijatara značajno pao (97 prijava u 2010. godini u odnosu na 205 u 2009., odnosno 445 u 2008. godini) što se može objasniti padom broja prijava nuspojava cjepiva iz obveznog programa cijepljenja djece predškolske dobi, a kojih je najviše bilo tijekom 2008. godine (vidi i Izvješće nuspojava za 2008. godinu). Liječnici bez specijalizacije ili oni koji nisu naveli svoju specijalizaciju tijekom 2010. godine prijavili su gotovo trećinu nuspojava (31%). Broj prijava od strane ljekarnika ostao je stabilan u 2010. godini u kojoj je stiglo 271 prijava iz tog izvora što čini nešto više od 20% svih prijava nuspojava na lijekove (vidi sliku 5).
Kao i prethodnih godina, najveći broj prijava HALMED zaprima izravno od samih zdravstvenih radnika (693 prijave, 52%), a nešto više od petine ukupnog broja (291 prijava, 22%) stiže posredstvom HZJZ-a koji s epidemiološkog stajališta zajedno s HALMED-om prati sigurnost primjene cjepiva koja se nalaze u prometu u Republici Hrvatskoj (Tablica 5).
Tijekom 2010. godine HALMED je zaprimio 331 prijavu od strane nositelja odobrenja za stavljanje gotovog lijeka u promet, što čini 25% ukupnog broja prijava. To je u Izvješćima najviše zabilježeni broj prijava od strane nositelja što pokazuje da ozbiljno shvaćaju svoju ulogu u praćenju i nadziranju sigurnosnog profila svojih lijekova na tržištu (Tablica 5). Nadamo se da će broj prijava od strane nositelja odobrenja u nadolazećim godinama polako preuzimati primat pred ostalim kao što je to trend u zemljama članica Europske unije. Tijekom 2010. godine HALMED je zaprimio samo 7 prijava od pacijenata/korisnika lijeka, što se može objasniti nedostatkom tradicije izravnog prijavljivanja nuspojava regulatornim tijelima. Ovo je pokazatelj da bi u Hrvatskoj trebalo podići razinu javne svijesti o važnosti izravnog prijavljivanja nuspojava HALMED-u. (Tablica 4).
Tablica 4. Izvori prijava nuspojava u 2010. godini (u zagradama broj prijava iz 2009. godine)
| Izvor prijave | Broj prijava |
|---|---|
| Liječnik (bez specijalizacije) | 412 (323) |
| Farmaceuti | 271 (225) |
| Stomatolozi | 2 (1) |
| Ostali zdravstveni radnici | 2 (3) |
| Liječnici Specijalisti | |
| Psihijatar | 37 (45) |
| Internist (nesp.) | 31 (28) |
| Dermatovenerolog | 14 (23) |
| Pedijatar | 97 (205) |
| Infektolog | 9 (9) |
| Ginekolog | 5 (7) |
| Specijalist obiteljske medicine | 87 (107) |
| Neurolog | 4 (1) |
| Epidemiolog | 19 (18) |
| Specijalist školske medicine | 123 (82) |
| Reumatolog | 1 (2) |
| Onkolog | 5 (5) |
| Fizijatar | 10 (3) |
| Endokrinolog | 3 (1) |
| Gastroenterolog | 4 (1) |
| Klinički farmakolog | 10 (3) |
| Anesteziolog | 5 (3) |
| Kardiolog | 11 (0) |
| Pulmolog | 4 (0) |
| Transfuziolog | 6 (1) |
| Urolog | 2 (2) |
| Radiolog | 1 (0) |
| Hematolog | 2 (0) |
| Nuklearna Medicina | 1 (0) |
| Otorinolaringolog | 4 (2) |
| LIJEČNICI SPECIJALISTI UKUPNO: | 495 (555) |
| Ostali | |
| Pacijenti/korisnici lijeka | 7 (1) |
| Nepoznat | 133 (60) |
| UKUPNO PRIJAVA: | 1322 (1165) |
Slika 4. Broj prijava po izvorima prijavitelja od 2005. do 2010. godine
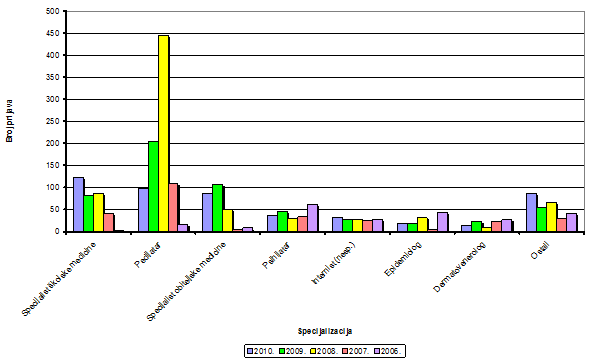
Slika 5. Broj prijava po specijalizacijama liječnika u razdoblju 2006.-2010. godine za koje je specijalizacija poznata kroz prijavu nuspojave
U kategoriji "nepoznat izvor prijave" (Slika 4 i Tablica 4) poznato je da se radi o zdravstvenim radnicima, ali nije poznat njihov profil (liječnik, farmaceut itd.). Radi se o kategoriji koja se najčešće javlja kod prijava nositelja odobrenja te se na taj način objašnjava i porast broja prijavitelja u toj kategoriji u 2009. i posebno 2010. godini što korelira s povećanim brojem prijava od nositelja odobrenja u zadnje dvije godine.
Kroz godine je uočeno da je kod liječnika za koje je poznata specijalizacija najveći broj prijava dolazi od strane pedijatara. To je zato jer pedijatri prvenstveno prijavljuju nuspojave cjepiva i zbog toga bilježimo i izraziti porast u udjelu prijavitelja od strane pedijatara u 2008. godini jer je u toj godini bilo najviše prijava nuspojava cjepiva koja su se javljala u djece predškolske dobi. Specijalisti školske medicine također u najvećem broju prijava prijavljuju nuspojave cjepiva, a kako su se nuspojave cjepiva u 2010. godini počele više bilježiti u djece školske dobi, broj prijava od specijalista školske medicine je porastao. Slijedom toga, u 2010. godini zaprimljeno je najviše prijava od strane specijalista školske medicine u odnosu na druge specijalizacije (uzete su u obzir prijave za koje je specijalizacija poznata). Slijede specijalisti obiteljske medicine koji su najčešće u kontaktu s pacijentima, imaju uvid u njihovu cjelokupnu terapiju, a i time i interakcije koje su mogle biti uzrok prijavljenim nuspojavama. Broj prijava od strane psihijatara stabilan je tijekom proteklih godina i ne bilježi se veći broj prijava u 2010. godini. Na petom mjestu su internisti čiji je udio neočekivano nizak s obzirom da je poznato da je polipragmazija u liječenju internističkih bolesti česta, a time i broj mogućih nuspojava. Epidemiolozi koji prijavljuju prvenstveno nuspojave cjepiva su na šestom mjestu, a dermatovenerolozi na sedmom. Ovi potonji u svom svakodnevnom radu dijagnosticiraju simptome koje su u svojoj osnovi nuspojave lijekova i to prvenstveno alergijske prirode te bi bilo za očekivati da prijavljuju u većoj mjeri nuspojave. U kategoriji "ostali specijalisti" su svi oni koji godišnje nisu prijavili više od 10 nuspojava. Tu se nalaze klinički farmakolozi, a potom neurolozi i onkolozi za koje se očekuje da prijavljuju mnogo veći broj nuspojava s obzirom na lijekove koje koriste u liječenju svojih bolesnika (antiepileptici, citostatska terapija, biološka terapija...).
Slika 6. Udio prijava pojedinih struka zdravstvenih radnika od 2005 do 2010. godine
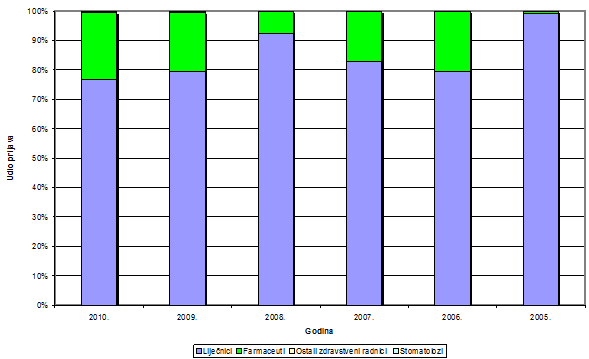
Slika 6 pokazuje udio pojedinih zdravstvenih radnika u prijavljivanju nuspojava u kojem tradicionalno dominiraju liječnici, ali od 2006. godine počinjemo bilježiti i prijave od strane farmaceuta. To je povezano s edukacijama o načinu, mjestu i značenju prijava nuspojava od strane farmaceuta koje HALMED provodi od 2005. godine (vidi i odlomak o radionicama). Tijekom godina bilježi se lagani pad do 2008. godine, da bi nakon toga udio prijava od strane farmaceuta ponovno počeo rasti i drži oko 20% svih prijavljenih nuspojava. Prijave od medicinskih sestara, medicinskih tehničara, farmaceutskih tehničara i stomatologa su nažalost malobrojne. Stoga HALMED planira dodatne edukacije navedenih zdravstvenih radnika u svrhu poticanja prijavljivanja nuspojava.
Broj prijava iz bolničkih ustanova ostao je nepromijenjen (23%). Uzevši u obzir informacije iz 2010. godine i prve polovine ove godine, čini se da napori HALMED-a u senzibilizaciji prijavitelja iz bolničkih ustanova ipak daju rezultata što je i dodatni motiv da se program edukacije proširi na ostale bolničke ustanove diljem Hrvatske (Tablica 5 i Slika 7). Također, važnost prijavljivanja nuspojava u osiguranju kvalitete pružene usluge svojim pacijentima neke su bolnice prepoznale i započele s vrlo kvalitetnim prijavama nuspojava. U buduće će HALMED objavljivati i pregled broja prijava po bolnicama u odnosu na broj kreveta i kategorizaciju bolnice kao indikatora kvalitete pružanja usluge pacijentima u smislu sigurne primjene lijekova. Nuspojave iz bolničkih ustanova su i inače od posebnog značaja jer obično produžuju hospitalizaciju ili dovode do hospitalizacije pa time uvijek spadaju u kategoriju ozbiljnih nuspojava.
Tablica 5. Izvori prijava po broju prijava nuspojava prema ustanovama (u zagradama su navedeni podaci iz 2009. i 2008. godine)
| Ustanova | Broj prijava |
|---|---|
| Ordinacije obiteljske medicine | 237 |
| Ljekarne | 267 |
| Klinička bolnica ili Klinički bolnički centar | 182 (163) (97) |
| Psihijatrijska ordinacija | 27 |
| Opće bolnice | 101 |
| Hrvatski zavod za javno zdravstvo | 10 |
| Županijski zavodi za javno zdravstvo | 172 |
| Pedijatrijska ordinacija | 85 (162) (380) |
| Ginekološka ordinacija | 2 |
| Specijalna bolnica | 22 |
| Ordinacija školske medicine | 2 |
| Stomatološka ordinacija | 1 |
| Ostalo | 24 |
| Nepoznato | 189 |
| UKUPNO PRIJAVA: | 1322 |
Slika 7. Udio pojedinih ustanova kao izvor prijavljivanja nuspojava u 2010. godini

Slika 7 prikazuje udio pojedinih ustanova u prijavljivanju nuspojava. U primarnu zdravstvenu zaštitu uračunate su prijave ordinacija obiteljske medicine, ginekoloških i pedijatrijskih ordinacija, a u bolničku zaštitu sve vrste bolnica i bolničkih centara. Posebno su izdvojeni zavodi za javno zdravstvo koji su važni u sustavu prijavljivanja nuspojava cjepiva te ljekarne. 16% ustanova nije identificirano kroz prijavu, a to je ponovno posljedica povećanog broja prijava od nositelja odobrenja gdje ova informacija nedostaje iz razloga zaštite podataka prijavitelja.
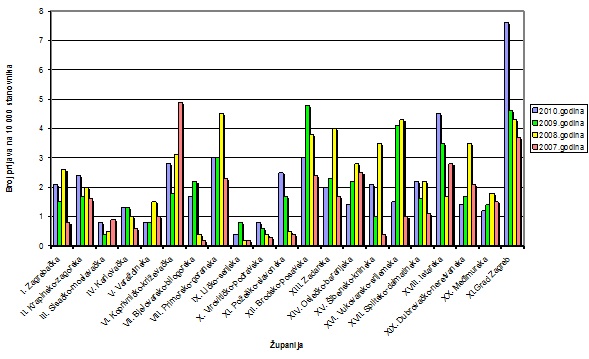
HALMED je i u 2010. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. U 11 županija zabilježen je porast broja prijava u odnosu na 2009. godinu. Najviše prijava pristiglo je s područja Grada Zagreba - 593, zatim slijede Splitsko-dalmatinska županija (102 prijave), Primorsko-goranska (92 prijave) te Istarska (90 prijava).
Prosječan broj prijava izražen na 10 000 stanovnika za cijelu Republiku Hrvatsku porastao je u odnosu na 2009. godinu i sada iznosi 3 prijave. U odnosu na prosjek Republike Hrvatske, 18 županija bilježi ispodprosječne rezultate, 2 županije bilježe identični rezultat kao i prosjek (Primorsko-goranska i Brodsko-posavska), a dvije županije, Grad Zagreb i Istarska, su iznad državnog prosjeka. Razlog izraženom porastu broja prijava iz Grada Zagreba posljedica je povećanog broja prijava od strane nositelja odobrenja i činjenice da su njihova sjedišta upravo u Zagrebu.
Na temelju ovih podataka HALMED će i dalje planirati održavanje Radionica o ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske.
Tablica 6. Izvori prijava nuspojava lijekova i cjepiva prema županijama u 2010. godini u usporedbi s 2007., 2008. i 2009. godinom
| Županija | Broj prijava u 2010. godini | Broj prijava na 10 000 stanovnika 2010. |
Broj prijava na 10 000 stanovnika 2009. 2008. 2007. |
|---|---|---|---|
| I. Zagrebačka | 64 | 2,1 | 1,45 - 2,6 - 0,8 |
| II. Krapinsko-zagorska | 34 | 2,4 | 1,7 - 2 - 1,6 |
| III. Sisačko-moslavačka | 15 | 0,8 | 0,43 - 0,5 - 0,9 |
| IV. Karlovačka | 18 | 1,3 | 1,3 - 1 - 0,6 |
| V. Varaždinska | 14 | 0,8 | 0,8 - 1,5 - 1,0 |
| VI. Koprivničko-križevačka | 33 | 2,75 | 1,8 - 3,1 - 4,9 |
| VII. Bjelovarsko-bilogorska | 22 | 1,7 | 2,15 - 0,4 - 0,2 |
| VIII. Primorsko-goranska | 92 | 3 | 3 - 4,5 - 2,3 |
| IX. Ličko-senjska | 2 | 0,4 | 0,8 - 0,2 - 0,2 |
| X. Virovitičko-podravska | 7 | 0,8 | 0,55 - 0,4 - 0,3 |
| XI. Požeško-slavonska | 20 | 2,5 | 1,65 - 0,5 - 0,35 |
| XII. Brodsko-posavska | 53 | 3 | 4,8 - 3,8 - 2,4 |
| XIII. Zadarska | 32 | 2 | 2,25 - 4 - 1,7 |
| XIV. Osječko-baranjska | 47 | 1,4 | 2,2 - 2,8 - 2,5 |
| XV. Šibensko-kninska | 23 | 2,1 | 1 - 3,45 - 0,4 |
| XVI. Vukovarsko-srijemska | 29 | 1,45 | 4,1 - 4,25 - 1,0 |
| XVII. Splitsko-dalmatinska | 102 | 2,2 | 1,6 - 2,15 - 1,1 |
| XVIII. Istarska | 90 | 4,5 | 3,5 - 1,7 - 2,8 |
| XIX. Dubrovačko-neretvanska | 16 | 1,4 | 1,7 - 3,5 - 2,1 |
| XX. Međimurska | 14 | 1,2 | 1,4 - 1,8 - 1,5 |
| Grad Zagreb | 593 | 7,6 | 4,55 - 4,25 - 3,7 |
| UKUPNO PRIJAVA: | 1322 | 3 | 2,6 - 2,85 |
Slika 8. Broj prijava na 10 000 stanovnika po županijama za razdoblje 2007.-2010. godina
1.2. Karakteristike prijava nuspojava lijekova i cjepiva
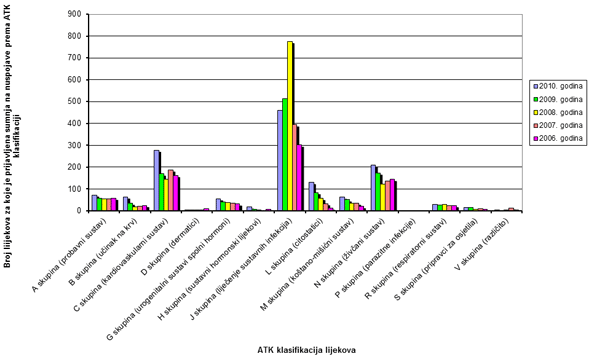
Kao i ranijih godina najviše prijava nuspojava zabilježeno je za lijekove iz skupine J (Lijekovi za liječenje sustavnih infekcija), no u odnosu na 2009. godinu zamjetan je pad broja prijava, prije svega zbog manjeg broja prijava nuspojava na cjepiva. Na drugom mjestu su lijekovi iz skupine C (Lijekovi za kardiovaskularni sustav) za koje je prijavljeno 278 sumnji na nuspojavu, što predstavlja povećanje od 64% u odnosu na 2009. godinu. Vjerojatno objašnjenje ovog rasta može se naći u činjenici da je prosjek godina pacijenata za koje su prijavljene nuspojave u 2010. godini bitno veći u usporedbi s prosjekom godina pacijenata iz 2009. godine, a to opet ima veze sa smanjenim brojem prijava za cjepiva koje su bile uočene u djece nižih dobnih skupina. Na trećem mjestu su Lijekovi iz skupine živčanog sustava (skupina N) gdje vodeće mjesto zauzimaju antipsihotici. Ukupan broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava, jer se u jednoj prijavi mogu naznačiti sumnje na nuspojave više lijekova (Tablica 7). Uočava se lagani trend povećavanja broja prijava skupine L (citostatici) što je i za očekivati jer ova skupina lijekova ima i najviše ozbiljnih i teških nuspojava. Također se uočava vrlo lagani trend povećavanja broja prijava iz skupine M (koštano-mišićni sustav) (Slika 9).
Tablica 7. Apsolutni broj lijekova za koje je prijavljena sumnja na nuspojave prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji (usporedba s 2009. godinom)
| ATK klasifikacija | Broj prijava | |
|---|---|---|
| 2010. | 2009. | |
| ATK 1. razina A skupina (probavni sustav) | 73 | 58 |
| ATK 1. razina B skupina (učinak na krv) | 64 | 35 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 278 | 169 |
| ATK 1. razina D skupina (dermatici) | 5 | 3 |
| ATK 1. razina G skupina (urogenitalni sustavi spolni hormoni) | 56 | 41 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 18 | 8 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 460 | 514 |
| ATK 1. razina L skupina (citostatici) | 130 | 84 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 63 | 51 |
| ATK 1. razina N skupina (živčani sustav) | 209 | 173 |
| ATK 1. razina P skupina (parazitne infekcije) | 0 | 0 |
| ATK 1. razina R skupina (respiratorni sustav) | 30 | 28 |
| ATK 1. razina S skupina (pripravci za osjetila) | 16 | 15 |
| ATK 1. razina V skupina (različito) | 3 | 2 |
| UKUPNO LJEKOVA: | 1405 | 1181 |
Slika 9. Apsolutni broj lijekova za koje je prijavljena sumnja na nuspojave prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2010. godine
Kako se da uočiti iz tablice 8 došlo je do svojevrsne preraspodjele među najmlađim dobnim skupinama - uočeni pad broja prijava sumnji na nuspojave cjepiva značajno je smanjio i broj prijava za dvije najmlađe dobne skupine (nuspojave cjepiva u programu cijepljenja predškolske djece), a dobne skupine od 3-6 i 7-14 zabilježile su porast broja prijava nuspojava na lijekove, ali bez generiranja sigurnosnog signala. Kao i prethodnih godina, nastavljen je rast broja prijava za središnje dobne skupine.
Tablica 8. Prijave nuspojava lijekova i cjepiva prema dobi bolesnika za 2010. godinu u usporedbi s 2009. i 2008. godinom
| Dob bolesnika | Broj prijava u 2010. godini | Broj prijava u 2009. godini | Broj prijava u 2008. godini |
|---|---|---|---|
| Do 12 mjeseci | 37 | 87 | 131 |
| 1 do 2 godine | 21 | 105 | 295 |
| 3 do 6 godina | 136 | 90 | 112 |
| 7 do 14 godina | 143 | 99 | 104 |
| 15 do 17 godina | 16 | 22 | 13 |
| 18 do 40 godina | 179 | 164 | 119 |
| 41 do 64 godine | 371 | 313 | 237 |
| 65 do 74 godina | 213 | 155 | 141 |
| 75 do 84 godina | 101 | 80 | 71 |
| 85 godina i starije | 6 | 4 | 8 |
| Neupisana dob | 101 | 46 | 34 |
| UKUPNO: | 1322 | 1165 | 1265 |
Tablica 9. Prijave sumnji na nuspojavu prema spolu bolesnika (usporedba s podacima iz 2007., 2008. i 2009. godine)
| Spol | Broj prijava | % ukupnog broja prijava u 2010. godini | % ukupnog broja prijava u 2009. godini | % ukupnog broja prijava u 2008. godini | % ukupnog broja prijava u 2007. godini |
|---|---|---|---|---|---|
| Muškarci | 555 | 42 | 39 | 47 | 44 |
| Žene | 733 | 55 | 58 | 52 | 54 |
| Nepoznato | 34 | 3 | 3 | 1 | 2 |
| UKUPNO: | 1322 | 100 | 100 | 100 | 100 |
Slika 10. Prijava sumnji na nuspojave po spolu bolesnika u 2010. godini

U svakom od šest dosadašnjih Izvješća veći dio sumnji na nuspojave lijekova prijavljuju se za osobe ženskog spola. U odnosu na muški spol žene su zastupljene u više od 50% (od 58 do 52%).
Nuspojave se osnovno dijele na nuspojave tipa A (posljedica pretjeranog farmakološkog učinka) i nuspojave tipa B u koje spadaju imunoalergijske reakcije, pseudoalergijske reakcije, metabolička intolerancija i idiosinkrazije. Od ukupno 2887 prijavljenih nuspojava, u 439 slučaja možemo govoriti o reakcijama tipa B, što je 15% svih nuspojava (identično i u 2009. godini).
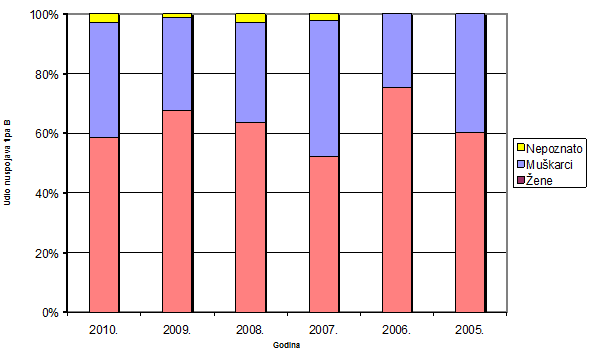
U 2010. godini značajno manje nuspojava tipa B prijavljeno je kod osoba ženskog spola. Nije u potpunosti jasno zbog čega bi nastupio takav pad, ali potencijalno objašnjenje bi se moglo pronaći u činjenici da je cjelokupni uzorak bitno stariji od prošlogodišnjeg. Kod 3% prijava, spol nije bio poznat (Tablica 11).
U nekoliko slučajeva kod prijava nuspojava tipa F (sumnja na nedjelotvornost lijeka), uslijedila je regulatorna akcija provjere kakvoće lijeka na koji je takva nuspojava bila prijavljena. Napominjemo da prijavljivanje nedjelotvornosti lijeka može stvoriti signal mogućih interakcija među lijekovima koji kada se daju istovremeno djeluju na način da izostane djelovanje jednog ili više lijekova (primjer klopidogrela i omeprazola).
Tablica 10. Vrste prijavljenih nuspojava u 2010. godini u usporedbi s prijavama iz 2009. i 2008. godine
| Vrsta nuspojava | Broj nuspojava 2010. | Broj nuspojava 2009. | Broj nuspojava 2008. | % 2010. | % 2009. | % 2008. |
|---|---|---|---|---|---|---|
| Tip A | 2432 | 1981 | 1801 | 84,0 | 84,0 | 81,4 |
| Tip B | 439 | 358 | 395 | 15,0 | 15,0 | 17,8 |
| Tip F | 16 | 16 | 16 | 1,0 | 1,0 | 0,8 |
| UKUPNO: | 2887 | 2355 | 2212 | 100,0 | 100,0 | 100,0 |
Tablica 11. Odnos spola i reakcija tipa B u 2010. godini u usporedbi s podacima iz 2009. godine u zagradi
| Spol | Broj nuspojava tipa B | % |
|---|---|---|
| Muškarci | 169 (111) | 39 (31) |
| Žene | 257 (242) | 58 (68) |
| Nepoznato | 13 (5) | 3 (1) |
| UKUPNO: | 439 | 100 |
Slika 11. Udio nuspojava tipa B po spolu bolesnika/korisnika lijekova u razdoblju 2005.-2010. godina
1.2.4. Broj lijekova u istovremenoj primjeni
U usporedbi s 2009. godinom, u 2010. uočava se porast broja osoba koje istovremeno uzimaju više lijekova i to u starijim dobnim skupinama: porast od 52% istovremenog uzimanja 2-3 lijeka i 53% za istovremeno uzimanje 4-5 lijekova za skupinu od 41-64 godine; porast od 78% istovremenog uzimanja 2-3 lijeka i 47% istovremenog uzimanja 4-5 lijekova te 42% povećanja istovremenog uzimanja više od 5 lijekova u dobnoj skupini 65 - 74 godina; 83% povećanje istovremenog uzimanja 4-5 lijekova u dobnoj skupini 75-84 godine. U ostalim dobnim skupinama nema većih promjena (Tablica 12). Ovakav trend je i u skladu s podacima o potrošnji lijekova koja raste godišnje za oko 8-10% te povećanom broju izdavanja lijekova na recept po bolesniku.
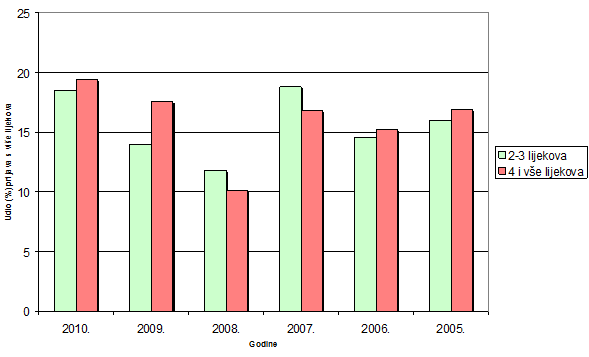
Promatranjem udjela broja prijava s dva i više lijekova u istovremenoj primjeni u odnosu na ukupni broj prijava nuspojava za pojedinu godinu u razdoblju od 2005. do 2010. godine uočava se pad takvih prijava u 2008. i 2009. godini. Uzrok tome je vjerojatno novi obrazac za prijavljivanje nuspojava koji se počeo koristiti krajem 2007. godine, a iz kojeg nije bilo potpuno jasno vidljivo da je pri prijavi potrebno upisati sve lijekove koje pacijent uzima, a ne samo one ili onaj lijek na koji se sumnja da je izravno izazvao nuspojavu. Ponovna promjena obrasca krajem 2009. godine najvjerojatnije je pridonijela ponovnom prijavljivanju svih lijekova u istovremenoj primjeni koja se sada ponovno može preglednije upisati. Istovremeno se kroz edukaciju koju je provodio HALMED radilo i na educiranju prijavitelja o važnosti navođenja svih lijekova koje pacijent istovremeno uzima što omogućava bolju stručnu interpretaciju nuspojava i bolje mogućnosti kod individualne intervencije na način da se modificiraju doze ili ukinu oni lijekovi koji zbog interakcija dovode do nuspojave, a da učinkovitost terapije ne bude narušena. Uzimanje više lijekova istovremeno eksponencijalno povećava mogućnost interakcije između brojnih lijekova, a time i pojave nuspojava koje su posljedica interakcija (Tablica 12). Uočava se rast broja prijava s 4 i više lijekova u istovremenoj terapiji u 2009. i 2010. godini u dobnoj skupini od 41-84 godina života. (Slika 15).
Tablica 12. Dob bolesnika i broj lijekova koje bolesnik istovremeno primjenjuje u 2010. godini (u zagradi usporedba s brojem lijekova za 2009. godinu)
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | UKUPNO |
|---|---|---|---|---|---|
| Do 12 mjeseci | 27 (78) | 10 (9) | 0 (0) | 0 (0) | 37 (87) |
| 1-2 godine | 18 (102) | 2 (2) | 1 (1) | 0 (0) | 21 (105) |
| 3-6 godina | 130 (87) | 6 (3) | 0 (0) | 0 (0) | 136 (90) |
| 7-14 godina | 127 (92) | 15 (7) | 0 (0) | 1 (0) | 143 (99) |
| 15-17 godina | 10 (17) | 4 (3) | 2 (2) | 0 (0) | 16 (22) |
| 18-40 godina | 99 (75) | 60 (64) | 14 (16) | 6 (7) | 179 (164) |
| 41-64 godine | 107 (112) | 154 (101) | 78 (51) | 32 (49) | 371 (313) |
| 65-75 godina | 45 (48) | 66 (37) | 65 (44) | 37 (26) | 213 (155) |
| 75-85 godina | 24 (19) | 30 (26) | 33 (18) | 14 (17) | 101 (80) |
| > 85 godina | 1 (1) | 1 (2) | 4 (0) | 0 (1) | 6 (4) |
| Neupisano | 80 (32) | 14 (8) | 5 (6) | 0 (0) | 99 (46) |
| UKUPNO: | 668 | 362 | 202 | 90 | 1322 (1165) |
Slika 12. Udio prijava s 2-3 lijeka u istovremenoj primjeni po dobnim skupinama u odrasloj dobi za razdoblje 2005.- 2010.

Slika 13. Udio prijava s 4-5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi za razdoblje 2005.- 2010.

Slika 14. Udio prijava više od 5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi za razdoblje 2005.-2010.
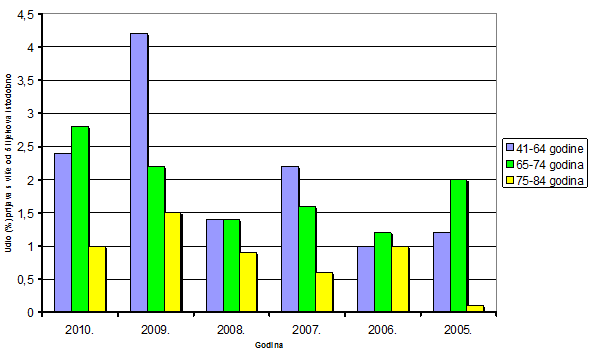
Slika 15. Udio prijava s više lijekova u istovremenoj primjeni u starijih odraslih bolesnika/korisnika lijeka od 41-84 godine života u razdoblju 2005.-2010. godine
U 2010. godini broj nuspojava koje ispunjavaju barem jedan od kriterija ozbiljnosti veći je od broja onih koji takve kriterije ne ispunjavaju. Nuspojave koje zadovoljavaju najmanje jedan od navedenih kriterija smatraju se u regulatornom smislu ozbiljnima:
- da se radi o medicinsko značajnom stanju koji se može smatrati ozbiljnim
- da je nuspojava uzrokovala hospitalizaciju (bolničko liječenje) ili produženje hospitalizacije
- da je došlo do razvoja anomalije kod novorođenčeta zbog toga što je majka uzimala lijek tijekom trudnoće
- da je nuspojava izazvala invalidnost ili trajnu nesposobnost
- da nuspojava ugrožava život bolesnika/korisnika lijeka
- da je nuspojava izazvala smrt osobe
Zanimljivo je da je tako visok postotak ozbiljnih nuspojava zabilježen uz vrlo visok postotak prijava od strane farmaceuta - za očekivati bi bilo kako će ta skupina prijavljivati većinom ne-ozbiljne nuspojave.
Moguća objašnjenja ovog stanja kao i prethodne godine jesu:
- Stabilan broj prijava iz bolničkih ustanova za koje smo i očekivali da bi mogle promijeniti odnos ozbiljnih i ne-ozbiljnih nuspojava - ipak se u bolničkim ustanovama zdravstveni radnici susreću većinom s ozbiljnim nuspojavama.
- Broj lijekova u istovremenoj primjeni također bi mogao doprinijeti velikom broju ozbiljnih nuspojava kao posljedica interakcija koje često mogu završiti krvarenjem.
- Metodološke promjene koje je HALMED uveo pri analizi ozbiljnosti nuspojava (smjernice Europske agencije za lijekove (EMA) vezano za ocjenu ozbiljnosti nuspojava koje spadaju pod MedDRA organski sustav (SOC) Infekcije i infestacije; preporuke Brighton Colaboration Organization, tj. smjernice Svjetske zdravstvene organizacije za ocjenu nuspojava cjepiva) u 2008. godini pri čemu se sve nuspojave koje spadaju u navedeni organski sustav ocjenjuju kao ozbiljne.
- Primjena liste svih dijagnoza, simptoma i stanja koji se vode kao ozbiljne nuspojave objavljena je na internetskoj stranici HALMED-a u 2010. godini
Kao što se može vidjeti iz Tablice 13 i Tablice 14, broj prijava sumnji da je nuspojava određenog lijeka uzrokovala smrtni slučaj veći je u odnosu na 2009. godinu, ali je niži od broja prijava zabilježenih u 2007. i 2008. godini.
Tablica 13. Ozbiljnost prijavljenih nuspojava u 2010. godini (uz usporedbu s udjelom prijava s ozbiljnim nuspojavama za razdoblje 2007.-2009.)
| Ozbiljnost nuspojave | Apsolutni broj prijava u 2010. | % u 2010. | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|
| Ozbiljne | 691 | 52 | 46 | 50,7 | 26 |
| Ostale | 631 | 48 | 54 | 49,3 | 74 |
| UKUPNO: | 1322 | 100 | 100 | 100,0 | 100 |
Tablica 14. Ozbiljne nuspojave prijavljene u 2010. godini - kriteriji prema ICH smjernici E2A u usporedbi s 2007., 2008. i 2009. godinom (u zagradi broj prijava)
| Kriterij | Broj prijava u 2010. godini | % u 2010. | % u 2009. | % u 2008. | % u 2007. |
|---|---|---|---|---|---|
| Smrt | 23 | 3 | 2,0 (10) | 4,0 (26) | 4 |
| Hospitalizacija | 161 | 23 | 20,0 (110) | 20,2 (132) | 41 |
| Invalidnost | 0 | 0 | 0,0 (0) | 0,0 (0) | 0 |
| Ugrožava život | 44 | 6 | 4,5 (25) | 5,1 (33) | 14 |
| Prirođena anomalija | 5 | 1 | 0,5 (2) | 0,0 (0) | 0 |
| Medicinski značajno ozbiljno stanje | 474 | 66 | 73,0 (402) | 70,7 (461) | 37 |
| UKUPNO: | 707* | 100 | 100,0 | 100,0 | 100 |
*neke nuspojave ispunjavaju nekoliko kriterija ozbiljnosti pa je ukupan zbroj u Tablici 14 veći od ukupnog broja prijava ozbiljnih nuspojava
U 2010. godini zabilježen je povećan broj oporavaka s posljedicama nakon razvoja nuspojave, no takva vrsta ishoda još uvijek predstavlja tek 1% svih nuspojava. Nažalost, velik broj prijava i dalje nema podatka o ishodu nuspojave. Objašnjenje je visok udio prijava od farmaceuta i nositelja odobrenja, čije prijave u pravilu ne sadrže ovaj podatak (Tablica 15).
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljeno je u 23 slučaja.
U navedene 23 prijave sumnji na smrtni ishod niti u jednom slučaju nije utvrđena sigurna povezanost između primjene lijeka i smrtnog ishoda. U tri slučaja nuspojava je označena kao nepovezana sa smrtnim ishodom (smrtni ishod nastupio kao posljedica bolesti pacijenta u vrijeme liječenja pacijenta s lijekom koji je razvio neku nuspojavu koja nije povezana sa smrtnim ishodom); u tri slučaja je ocijenjeno kako ta povezanost s lijekom nije vjerojatna; dok je u 17 slučajeva jedna od nuspojava označena kao moguće doprinoseća smrtnom ishodu.
Lijekovi za koje se sumnja da su uzrokovali nuspojave koje su povezane sa smrtnim ishodom spadaju prema ATK klasifikaciji SZO u skupinu L- citostatici (11 prijava), skupinu N-živčani sustav (4 prijave), zatim C-kardiovaskularni sustav (2 prijave), A-probavni sustav (2 prijave), skupinu B-lijekovi s učinkom na krv (tri prijave), skupinu J-liječenje sustavnih infekcija (dvije prijave) skupinu G-urogenitalni sustav i spolni hormoni te M-koštano-mišićni sustav (jedna prijava). Zbroj prijava po skupinama veći je od ukupnog broja prijava, jer je u pojedinim prijavama bilo navedeno više lijekova koji su pripadali različitim skupinama ATK klasifikacije lijekova (pr. prijava 1. imala dva lijeka, jedan G, drugi M skupina i to je ovdje razvrstano kao dvije prijave).
Važno je naglasiti kako se u najvećem broju smrtnih slučajeva za koje se sumnja da su povezane s lijekovima, radi o bolesnicima s teškom osnovnom bolešću (karcinom pluća, multipli mijelom, kronična mijeloična leukemija, tumor mozga) što dodatno otežava procjenu povezanosti lijeka i nuspojave sa smrtnim ishodom.
Tablica 15. Udio nuspojava lijekova i cjepiva prijavljenih u 2010. godini s ishodom nuspojava u usporedbi s udjelom u 2009. i 2008. godinom
| Ishod nuspojave | Broj prijava u 2010. godini | % u 2010. | % u 2009. | % u 2008. |
|---|---|---|---|---|
| Oporavak bez posljedica | 1537 | 53 | 59,0 | 54,2 |
| Oporavak s posljedicama | 27 | 1 | 0,5 | 0,3 |
| U tijeku | 251 | 9 | 5,5 | 20,0 |
| Bez oporavka/Nepoznato | 1017 | 35 | 34,0 | 23,5 |
1.2.7. Stupanj povezanosti nuspojave i lijeka
Za ocjenu povezanosti upotrijebljena je Klasifikacija Svjetske zdravstvene organizacije (WHO) koja je modificirana procjena povezanosti prema Karch-Lasagnai. Prijave koje dolaze u HALMED u pravilu ne sadrže ocjenu povezanosti od strane prijavitelja (Tablica 16). Dio objašnjenja za takvu situaciju moguće je pripisati visokom udjelu farmaceuta u uzorku prijavljivača koji nisu skloni davati takvu ocjenu. Također, veliki broj prijava od strane nositelja odobrenja ne sadrži ocjenu povezanosti ili je ona u formatu nespojivom s HALMED-ovim. Za razliku od prethodnog izvješća, u ocjeni HALMED-a uočavamo jednak broj moguće i vjerojatne povezanosti primjene lijeka i razvoja nuspojave (prijave su ukupno bile "siromašnije" podacima kao što su oni o nestanku nuspojave nakon prekida davanja lijeka (pozitivan dechallenge), odnosno ponovnoj pojavi nuspojave kod ponovnog davanja lijeka (negativan rechallenge).
Tablica 16. Povezanost primjene lijeka i nuspojave prema ocjeni prijavitelja i HALMED-a u 2010. godini (podaci za 2009. godinu u zagradi)
| Povezanost lijeka i nuspojave | Ocjena prijavitelj | Ocjena HALMED-a |
|---|---|---|
| Sigurna | 142 (29) | 138 (88) |
| Vjerojatna | 238 (531) | 566 (669) |
| Moguća | 81 (168) | 565 (380) |
| Nije vjerojatna | 2 (11) | 50 (26) |
| Nije moguće klasificirati | 0 (22) | 3 (2) |
| Nedostaje procjena | 859 (404) | - |
| UKUPNO: | 1322 | 1322 |
1.2.8. Nuspojave po organskim sustavima
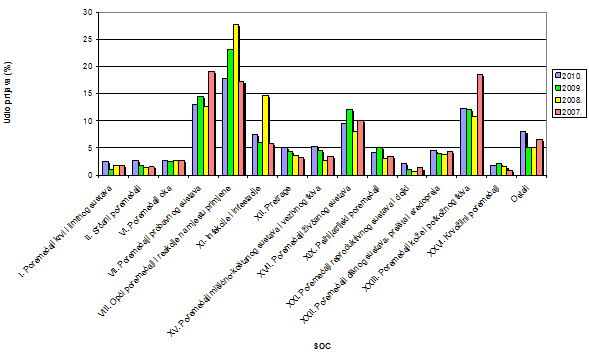
Nuspojave su navedene prema MedDRA-inoj klasifikaciji organskih sustava (MedDRA - Medical Dictionary for Regulatory Activities- Medicinski rječnik za regulatorne poslove) koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom polju. U 2010. godini prijavljene nuspojave su nešto ravnomjernije raspoređene po organskim sustavima (SOC) te bez najviših točaka koje smo mogli zamijetiti u nekim ranijim godinama. Najviše točke su zapravo bile signali za neka sigurnosna događanja u proteklom razdoblju što je obrađeno u prijašnjim godišnjim izvješćima (Slika 17). Tako "ujednačeno prijavljivanje" nuspojava govori i o tome da je 2010. godina u Republici Hrvatskoj bila mirna što se tiče sigurnosnih pitanja.
Najveći broj nuspojava zabilježen za SOC-eve kao i prošlih godina: najviši je udio nuspojava iz SOC-a Opći poremećaji i reakcije na mjestu primjene (17,7% u usporedbi s 23,2% u 2009.) uz zamjetan pad broja prijava. Radi se o posljedici smanjenja broja prijava nuspojava na cjepiva jer su one najčešće iz te kategorija (na primjer povišena tjelesna temperatura i sl). Na drugom mjestu se i ove godine nalaze Poremećaji probavnog sustava (12,9% prema 14,5% iz 2009.) te Poremećaji kože i potkožnog tkiva s postotkom od 12,3 na trećem mjestu. HALMED je u 2010. godini zaprimio 8 prijava za SOC Dobroćudne, zloćudne i nespecificirane novotvorine, te četiri prijave za SOC Socijalne okolnosti (Tablica 17). U usporedbi s prijavama nuspojava zemalja zapadne Europe kao što je Švicarska vidljivo je da se u profilu prijava nuspojava poklapamo što se tiče Općih poremećaja i reakcija na mjestu primjene (1. mjesto), Poremećaja probavnog sustava (2. mjesto) i Poremećaja kože i potkožnog tkiva (3. mjesto).
Po prvi put bilježimo 5 prijava za SOC-eve Prirođeni, obiteljski i genetski poremećaji koji se inače ne prijavljuju ili se prijavljuju sporadično (1-2 prijave ranijih godina) i u grafu ulaze u kategoriju "ostali". S druge strane, u Švicarskoj su takve nuspojave navedene u više od 200 prijava i nalaze se na devetom mjestu. Ove nuspojave čine vrlo važnu kariku u boljoj ocjeni lijekova koji su važni i u terapiji trudnica, međutim važnost njihova prijavljivanja u Republici Hrvatskoj do sada nije dovoljno prepoznata od strane ginekologa, neonatologa i pedijatara. HALMED smatra da je potrebno veću pozornost posvetiti nuspojavama iz područja genetskih poremećaja i malformacija zbog njihova značaja za sigurnost primjene lijekova u trudnoći i slijedom toga radit će se na educiranju i informiranju zdravstvenih radnika i pacijenata. Važan partner na tom području su nositelji odobrenja od kojih je HALMED prošle godine zaprimio ranije navedene prijave.
Tablica 17. Nuspojave po MedDRA-inoj klasifikaciji organskih sustava u 2010. godini u usporedbi s udjelom u 2009., 2008. i 2007. godini
| Organski sustav (SOC) | Broj nuspojava u 2010. | Udio (%) nuspojava u 2010. godini | Udio (%) nuspojava u 2009. godini | Udio (%) nuspojava u 2008. godini | Udio (%) nuspojava u 2007. godini |
|---|---|---|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 72 | 2,5 | 1,1 | 1,8 | 1,7 |
| II. Srčani poremećaji | 78 | 2,7 | 1,8 | 1,4 | 1,5 |
| III. Prirođeni, obiteljski i genetski poremećaji | 5 | 0,2 | 0,1 | 0,0 | 0,2 |
| IV. Poremećaji uha i labirinta | 39 | 1,4 | 1,3 | 1,0 | 1,2 |
| V. Endokrini poremećaji | 23 | 0,8 | 0,1 | 0,1 | 0,2 |
| VI. Poremećaji oka | 74 | 2,6 | 2,5 | 2,7 | 2,7 |
| VII. Poremećaji probavnog sustava | 371 | 12,9 | 14,5 | 12,7 | 19,1 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 511 | 17,7 | 23,2 | 27,7 | 17,2 |
| IX. Poremećaji jetre i žuči | 15 | 0,5 | 0,6 | 0,5 | 0,3 |
| X. Poremećaji imunološkog sustava | 26 | 0,9 | 0,6 | 1,1 | 1,8 |
| XI. Infekcije i infestacije | 213 | 7,4 | 6,0 | 14,7 | 5,8 |
| XII. Pretrage | 147 | 5,1 | 4,3 | 3,6 | 3,2 |
| XIII. Prirođeni, obiteljski i genetski poremećaji | 5 | 0,2 | 0,1 | 0,0 | 0,2 |
| XIV. Ozljede, trovanja i proceduralne komplikacije | 45 | 1,6 | 0,7 | 0,4 | 0,0 |
| XV. Poremećaji metabolizma i prehrane | 30 | 1,0 | 0,9 | 0,7 | 1,3 |
| XVI. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 154 | 5,3 | 4,5 | 2,7 | 3,5 |
| XVII. Dobroćudne, zloćudne i nespecificirane novotvorine | 8 | 0,3 | 0,1 | 0,1 | 0,3 |
| XVIII. Poremećaji živčanog sustava | 274 | 9,5 | 12,1 | 8,0 | 10,0 |
| XIX. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 10 | 0,3 | 0,1 | 0,1 | 0,3 |
| XX. Psihijatrijski poremećaji | 120 | 4,2 | 5,1 | 3,0 | 3,5 |
| XXI. Poremećaji bubrega i mokraćnog sustava | 41 | 1,4 | 0,8 | 1,0 | 0,9 |
| XXII. Poremećaji reproduktivnog sustava i dojki | 64 | 2,2 | 1,1 | 0,6 | 1,3 |
| XXIII. Poremećaji kože i potkožnog tkiva | 354 | 12,3 | 12,1 | 10,8 | 18,5 |
| XXIV. Socijalne okolnosti | 4 | 0,1 | 0,1 | 0,1 | 0,1 |
| XXV. Operativni i medicinski postupci | 25 | 0,9 | 0,1 | 0,0 | 0,0 |
| XXVI. Krvožilni poremećaji | 52 | 1,8 | 2,2 | 1,6 | 0,9 |
| UKUPNO: | 2887 | 100,0 | 100,0 | 100,0 | 100,0 |
Slika 16. Udio nuspojava prema organskim sustavima u 2010. godini.
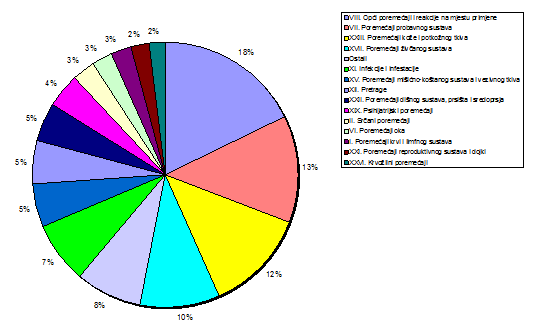
Slika 17. Udio nuspojava klasificiranih prema organskim sustavima po prijavama za razdoblje 2007.-2010.
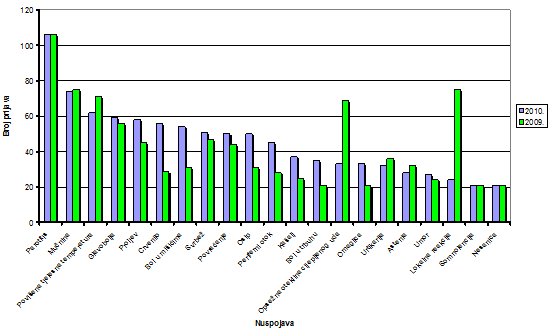
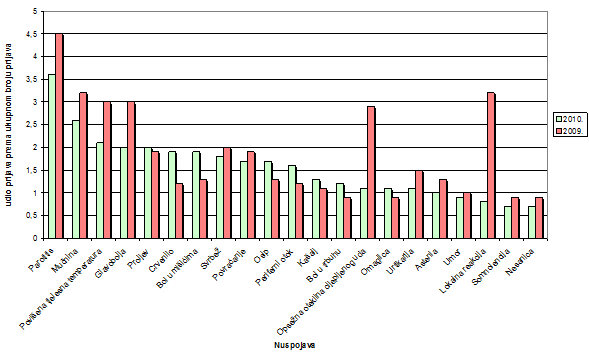
1.2.9. Najčešće prijavljene nuspojave u 2010. godini
Tablica 18. Najčešće prijavljene nuspojave u 2010. godini u usporedbi s prijavama iz 2009. godine
| Nuspojava | Broj prijava u 2010. godini |
Broj prijava u 2009. godini |
|---|---|---|
| Parotitis | 111 | 106 |
| Mučnina | 74 | 75 |
| Povišena tjelesna temperatura | 62 | 71 |
| Glavobolja | 59 | 56 |
| Proljev | 58 | 45 |
| Crvenilo | 56 | 29 |
| Bol u mišićima | 54 | 31 |
| Svrbež | 51 | 47 |
| Povraćanje | 50 | 44 |
| Osip | 50 | 31 |
| Periferni otok | 45 | 28 |
| Kašalj | 37 | 25 |
| Bol u trbuhu | 35 | 21 |
| Opsežna oteklina cijepljenog uda | 33 | 69 |
| Omaglica | 33 | 21 |
| Urtikarija | 32 | 36 |
| Astenia | 28 | 32 |
| Umor | 27 | 24 |
| Lokalna reakcija | 24 | 75 |
| Somnolencija | 21 | 21 |
| Nesanica | 21 | 21 |
Najčešće prijavljene nuspojave u 2010. godini bile su nuspojave iz skupina : opći poremećaji, poremećaji probavnog trakta, poremećaji kože i potkožnog dijela i poremećaji živčanog sustava. Navedene su samo one nuspojave koje su prijavljene više od 20 puta. U usporedbi s 2009. godinom iste nuspojave zauzimaju prvih dvadesetak mjesta s nešto promijenjenim udjelom u ukupnom broju nuspojava. Kao što je već ranije rečeno u 2009. godini bilo je više prijava na nuspojave cjepiva te su stoga tada dominirale nuspojave karakteristične za cjepiva: parotitis, mučnina, povišena tjelesna temperatura, glavobolja, opsežna oteklina cijepljenog uda i lokalne reakcije. S druge strane, u 2010. godini veći udio čine nuspojave kao što su mučnina, proljev, bol u mišićima, povraćanje, osip, periferni otok što su nuspojave koje su karakteristične za klasične sintetske lijekove. Pretpostavlja se da se u praksi dio simptoma ne prepozna kao nuspojava lijekova već se dijagnosticira "nova bolest" (hipertenzija, kardiovaskularni incidenti, prijelom kostiju, razvoj depresije).
Slika 18. Grafički prikaz najčešće prijavljenih nuspojava u 2010. godini u odnosu na 2009. godinu
Slika 19. Grafički prikaz udjela najčešće prijavljenih nuspojava u odnosu na ukupan broj prijavljenih nuspojava u 2010. godini te usporedba s 2009. godinom
2. Pregled sigurnosnih pitanja u 2010. godini
U 2010. godini nije bilo niti jednog sigurnosnog pitanja koje je bilo isključivo vezano za situaciju na domaćem tržištu. Provedene regulatorne akcije uslijedile su kao rezultat "kontinuirane procjene rizika i koristi" koje su donesene na temelju praćenja nuspojava lijekova kako na europskoj tako i na svjetskoj razini i novih informacija o sigurnosti primjene lijekova koji na taj način pristižu. U nastavku donosimo pregled nekih od najvažnijih sigurnosnih pitanja iz 2010. godine:
2.1. Rosiglitazon (Avandia, Avandamet, Avaglim, Roziglitazon Pliva)
Od 27. listopada 2010. godine lijekovi s djelatnom tvari rosiglitazon (indiciran u terapiji dijabetesa melitusa) više se ne nalaze na hrvatskom tržištu i tržištu Europske unije. Rezultat je to analize novih podataka o kardiovaskularnim rizicima povezanih s ovom djelatnom tvari. Postupak povlačenja ovih lijekova tekao je u Europskoj uniji i Republici Hrvatskoj postupno kako bi svi pacijenti dobili zamjensku terapiju bez prekida kronične terapije dijabetesa.
Rosiglitazon je zbog prepoznatih sigurnosnih podataka još iz faze kliničkih ispitivanja (povezanih sa zadržavanjem tekućine, povećanim rizikom od srčanog zatajenja te ishemijske bolesti srca) bio kontraindiciran za bolesnike sa srčanim problemima.
Kako je putem postmarketinških farmakovigilancijskih aktivnosti (praćenja nuspojava nakon što je lijek došao na tržište) postalo jasno da se tijekom primjene ovog lijeka u svakodnevnoj praksi nijednom novom mjerom minimizacije rizika ne može postići željeni učinak potpune sigurne primjene ovog lijeka - na način da pacijenti koji imaju rizične faktore ne uzimaju ovaj lijek u liječenju dijabetesa, rizik nastavka korištenja rosiglitazona prevladao je korist od uzimanja. Na temelju tih spoznaja donesena je odluka o povlačenju lijeka s tržišta Europske unije i Republike Hrvatske.
2.2. Sibutramin (Reductil)
Podaci iz kliničkog ispitivanja (Sibutramin Cardiovascular OUTcomes, SCOUT), koje je za cilj imalo ispitati učinke liječenja sibutraminom na kardiovaskularni sustav pacijenata s prekomjernom tjelesnom težinom i pretilih pacijenata (s poznatom kardiovaskularnom bolešću ili visokim rizikom za kardiovaskularnu bolest), ukazali su na povećan rizik za razvoj ozbiljnih kardiovaskularnih incidenata kao što su moždani ili srčani udar u pacijenata koji su liječeni sibutraminom u usporedbi s pacijentima koji su dobivali placebo (neaktivni lijek). Povjerenstvo za humane lijekove (Committee for Medicinal Products for Human Use, CHMP) Europske Agencije za lijekove (EMA-e) na temelju ocjene dostupnih podataka o sigurnosti i djelotvornosti primjene lijeka sibutramin smatralo je kako rizik primjene nadilazi korist te je preporučilo njegovo povlačenje u zemljama članicama Europske unije.
U nastavku navodimo detaljnije podatke o odluci i postupku povlačenja ovog lijeka s tržišta Europske unije i Republike Hrvatske:
Sibutramin (Reductil) učinak ostvaruje u središnjem živčanom sustavu inhibicijom ponovnog unosa serotonina i noradrenalina čime kod pacijenata izaziva osjećaj sitosti te se lijek koristio u liječenju pretilosti. Bio je indiciran kao pomoćna terapija uz dijetu i tjelovježbu u liječenju pretilosti kod: bolesnika čija je prekomjerna težina uzrokovana prehranom, a imaju indeks tjelesne mase (BMI) 30 kg/m2 ili veći te kod bolesnika čija je prekomjerna težina uzrokovana prehranom, a uz BMI od 27 kg/m2 ili veći imaju dodatne čimbenike rizika, kao što su dijabetes tipa 2 ili dislipidemija.
CHMP je zbog potencijalnih kardiovaskularnih rizika povezanih s terapijom sibutraminom, a koji su bili zapaženi u kliničkim ispitivanjima i postmarketinškim praćenjima nuspojava, bio zatražio provedbu navedenog kliničkog ispitivanja (SCOUT). U ispitivanje koje je trajalo šest godina bilo je uključeno približno 10 000 pacijenata s prekomjernom tjelesnom težinom udruženom s kardiovaskularnim čimbenicima rizika i/ili dijabetesom tipa 2. Rezultati ispitivanja su pokazali da su pacijenti liječeni sibutraminom imali za 16% povećan rizik od kardiovaskularnih incidenata poput infarkta miokarda ili moždanog udara u odnosu na pacijente koji su dobivali placebo. CHMP je ukazao i na skroman učinak sibutramina u smanjivanju tjelesne težine tijekom kliničkih ispitivanja koji je iznosio 2-4 kg više u odnosu na placebo. Nadalje, iz dostupnih podataka nije bilo jasno koliko bi učinak na smanjenje tjelesne težine bio dugotrajan nakon što se terapija sibutraminom prekine.
Iako bi liječenje sibutraminom u većine pacijenata uključenih u kliničko ispitivanje SCOUT u svakodnevnoj praksi bilo kontraindicirano, CHMP je prepoznao kardiovaskularni rizik kao ključan za kliničku praksu, jer u pacijenata s prekomjernom težinom i pretilih pacijenata nije uvijek moguće identificirati kardiovaskularnu bolest u podlozi. Stoga se zaključilo da daljnje restrikcije i upozorenja pri korištenju sibutramina ne bi smanjile rizik za pacijente na prihvatljivu razinu u svakodnevnoj primjeni ovog lijeka.
HALMED je u suradnji s nositeljem odobrenja za stavljanje u promet lijeka Reductil (Abbott Laboratories d.o.o., Zagreb) proveo obustavu opskrbe lijekom Reductil u Republici Hrvatskoj, te nije obnovio Rješenje za stavljanje lijeka u promet u Republici Hrvatskoj. Lijek više nije dostupan na našem tržištu niti u zemljama članicama Europske unije.
2.3. Klopidogrel (Clopidogrel Edicta, Farcet, Klopidex, Kogrel, Pigrel, Plavix, Zyllt) i omeprazol/esomeprazol (Emanera, Esomeprazol PharmaS, Nexium, Omezol, Ortalox, Ortanol, Target, Target plus, Ulzol, Ultop)
U 2010. godini postali su dostupni rezultati analize studija o mogućoj interakciji klopidogrela i inhibitora protonske pumpe (PPI) koja dovodi do nedjelotvornosti klopidogrela i posljedično do stvaranja ugrušaka (tromba) u krvnim žilama pacijenta, a to može dovesti do komplikacija poput embolije ili ponovnog začepljenja srčanih krvnih žila koje su bile prethodno operirane (ugradnja stenta, premosnice).
Klopidogrel je inhibitor agregacije trombocita te se primjenjuje kod sprečavanja nastanka tromba u stanjima kao što su infarkt miokarda ili moždani udar. Klopidogrel se konvertira u jetri u svoju aktivnu formu pomoću enzima citokroma P450 CYP2C19. PPI se primjenjuju za prevenciju i liječenje dispepsije i peptičkih ulkusa. S obzirom da dispepsija i peptički ulkusi mogu biti nuspojave terapije klopidogrelom, pacijenti koji uzimaju klopidogrel često istovremeno uzimaju i PPI za prevenciju ili olakšanje simptoma. PPI mogu spriječiti pretvaranje klopidogrela u aktivni oblik čime dovode do toga da lijek postane inaktivan i nedjelotvoran.
U međuvremenu je CHMP razmotrilo rezultate novih studija od kojih su neke stavile u pitanje klinički značaj interakcija PPI-a kao klase lijekova i klopidogrela. Dvije studije koje su završile krajem kolovoza 2009. godine, ispitivale su učinak omeprazola kao jednog od PPI-a na vrijednosti aktivnog oblika klopidogrela u krvi. Studije su potvrdile da omeprazol može smanjiti vrijednosti aktivnog oblika klopidogrela u krvi i smanjiti njegove antiagregacijske učinke, te time podupiru raniji zaključak da postoji interakcija između klopidogrela i omeprazola te njegovog izomera esomeprazola.
Uzimajući u obzir sve trenutno dostupne podatke, CHMP i njegova Radna skupina za farmakovigilanciju (PhVWP) su zaključili kako nema čvrstih temelja za proširenje upozorenja na sve ostale lijekove iz skupine PPI-a uz omeprazol i esomeprazol. Upozorenje o izbjegavanju istovremene primjene se odnosi samo na klopidogrel i omeprazol ili esomeprazol. CHMP je savjetovalo uključivanje opisa rezultata dvije nedavno provedene studije koje su pokazale interakciju između klopidogrela i omeprazola u sigurnosne podatke o ovim lijekovima.
2.4. Ketoprofen - oblici za lokalnu primjenu (Fastum gel, Ketonal 5% krema, KetoGel 2,5% gel, Ketospray 10%)
Ketoprofen je nesteroidni protuupalni lijek (NSAR) čiji topički farmaceutski oblici su namijenjeni primjeni kod manjih trauma, tendonitisa, osteoartritisa malih zglobova, akutne boli u križima i slično. U postmarketinškom praćenju nuspojava uočene su ozbiljne kožne fotoalergijske nuspojave nakon primjene lokalnih preparata ketoprofena. Postupak ponovne ocjene sigurnosti primjene ovih lijekova bio je iniciran signalom od razvoja fotosenzitivnih reakcija, uključujući fotoalergiju, i s mogućim novim rizikom od kosenzitizacije s oktokrilenom (kemijski filtar protiv sunca koji se nalazi kozmetičkim preparatima i preparatima za njegu). CHMP je zaključilo kako je rizik od teških fotoalergijskih reakcija vrlo mali (1 slučaj na milijun liječenih pacijenata), ali usprkos tome zbog težine reakcije potrebno je provođenje harmoniziranih mjera minimizacije rizika u Europskoj uniji.
U srpnju 2010. godine je na internetskim stranicama HALMED-a (link "Novosti") objavljeno priopćenje za javnost radi upozorenja i povećanja mjera opreza kod topičke primjene ketoprofena koji se temelje na podacima dobivenih od Europske agencije za lijekove (EMA):
- predmetni lijekovi ne bi više trebali biti dostupni bez recepta;
- potrebno je u podatke o lijeku (sažetak opisa svojstava lijeka, uputa o lijeku) uvrstiti dodatne informacije o izlaganju suncu uz upozorenje o kožnim nuspojavama pri istovremenoj primjeni s oktokrilenom;
- potrebna je jasno informirati zdravstvene djelatnike i pacijente o rizicima od fotoalergije kod topičke primjene ketoprofena i načina sprečavanja takvih reakcija.
HALMED je izmijenio način izdavanja ovih lijekova s bezreceptnog na receptni status u veljači 2011. godine. U suradnji s HALMED-om tvrtke koje u RH imaju odobrene lijekove za lokalnu primjenu koji sadrže ketoprofen uputile su početkom 2011. godine pismo zdravstvenim radnicima o promjeni načina njihova izdavanja. Zaključno, navedeni lijekovi se od 01. veljače 2011. izdaju isključivo na recept u ljekarnama i to je jedna je od mjera minimalizacije rizika razvoja ozbiljnih fotoalergijskih reakcija.
Preporuke za pacijente i zdravstvene djelatnike:
- Liječnici, ljekarnici i pacijenti trebaju biti svjesni rizika fotoalergijskih reakcija kod topičke primjene ketoprofena.
- Liječnici i ljekarnici trebaju obavijestiti svoje pacijente o pravilnoj primjeni lijekova s djelatnom tvari ketoprofenom.
- Pacijenti trebaju zaštititi liječena područja od izlaganja suncu tijekom cijelog razdoblja primjene ketoprofena i dva tjedna nakon prestanka primjene. Također, potrebno je pažljivo oprati ruke nakon svakog nanošenja ketoprofena.
- Ketoprofen se ne smije upotrebljavati istovremeno s preparatima koji sadrže oktokrilen (kemijski filter protiv sunca koji se nalazi kozmetičkim preparatima i preparatima za njegu).
- Pacijenti trebaju odmah prekinuti primjenu ketoprofena ako razviju bilo koju kožnu reakciju te potražiti liječnički savjet.
- U slučaju nejasnoća, pacijenti se trebaju obratiti svom liječniku ili ljekarniku.
HALMED tijekom 2010. godine nije zaprimio niti jednu prijavu koja bi uključivala nuspojave fotosenzitivnih kožnih reakcija za topičke lijekove s djelatnom tvari ketoprofenom.
2.5. Vorikonazol (Vfend)
Vorikonazol (Vfend) je lijek koji se primjenjuje za liječenje teških gljivičnih infekcija uzrokovanih gljivama iz roda Aspergillus, Scedosporium, Fusarium te iz roda Candida, koje su otporne na flukonazol i kandidemije u bolesnika s normalnim brojem bijelih krvnih stanica. Pismo liječnicima propisivačima poslano je kako bi im se skrenula pozornost na sve veći broj prijava hepatalnih nuspojava koje se javljaju u bolesnika koji uzimaju vorikonazol (Vfend). Točan mehanizam nastanka oštećenja jetre izazvanog vorikonazolom nije poznat. Opažena oštećenja jetre uključivala su kombinaciju hepatocelularno-kolestatskog, hepatocelularnog ili kolestatskog oštećenja. U pismu su dane smjernice o postupanju s bolesnicima kojima se propisuje vorikonazol i isto se može naći na internetskim stranicama HALMED-a.
2.6. Cjepivo protiv rotavirusa, živo (Rotarix)
U cjepivu protiv rotavirusa (Rotarix) koje se daje djeci staroj 6 tjedana ili starijima kako bi ih se zaštitilo od gastroenteritisa (proljev i povraćanje) uzrokovanog infekcijom rotavirusom, nađena je neočekivana prisutnost DNA svinjskog cirkovirusa tip 1. Ovaj virus se često nalazi u određenom mesu i drugim prehrambenim proizvodima te nije poznato da uzrokuje bolesti životinja ili ljudi. Opisani DNA nije nađen u ostalim živim atenuiranim cjepivima istog proizvođača, GSK Biologicals.
Zaključeno je kako ovaj nalaz ne predstavlja javnozdravstveni rizik te kako nije potrebno uvođenje ograničenja primjene cjepiva Rotarix.
Od proizvođača je zatraženo da identificira izvor virusa te da uvede mjere kako bi se proizvodilo cjepivo bez njegove prisutnosti.
2.7. Bufeksamak (Proctosan i Proctosan Forte)
U 2010. godini HALMED je ukinuo odobrenja za stavljanje u promet za lijekove s djelatnom tvari bufeksamak, a na temelju odluke Europske komisije. Lijekovi s ovom djelatnom tvari bili su indicirani u liječenju hemeroida i ekcema. Odluka o ukidanju odobrenja za stavljanje lijeka u promet je temeljena na znanstvenoj ocjeni koja je identificirala visok rizik od mogućih ozbiljnih kontaktnih alergijskih reakcija uzrokovanih bufeksamakom. Taj rizik je veći kod pacijenata s predisponirajućim stanjima, kao što su određeni oblici ekcema, za što se bufeksamak učestalo propisivao. Nadalje, alergijske reakcije uzrokovane bufeksamakom vrlo su slične bolestima koje se njime liječe, što potencijalno može dovesti do odgode u postavljanju pravilne dijagnoze i liječenju pacijenata. Također je moguće da su teškoće u razlikovanju neuspjeha u liječenju i alergijske reakcije dovele do smanjenog broja prijava nuspojava kontaktne alergijske reakcije. Dodatno, podaci koji podupiru djelotvornost bufeksamaka vrlo su ograničeni pa je Povjerenstvo zaključilo kako na temelju dostupnih podataka koristi primjene lijekova koji sadrže djelatnu tvar bufeksamak ne nadilaze rizike, te je stoga preporučeno povlačenje ovih lijekova s tržišta u Europskoj Uniji.
Na temelju donesenih preporuka Nositelj odobrenja za stavljanje gotovog lijeka u promet u Republici Hrvatskoj, Stada Hemofarm d.o.o., pokrenuo je u 2010. godini zahtjev za ukidanjem odobrenja iz sigurnosnih razloga za lijekove Proctosan i Proctosan Forte (bufeksamak, bizmut-subgalat, titan-dioksid, lidokain hidroklorid), a što je HALMED prihvatio. N tržištu Republike Hrvatske nema više dostupnih lijekova s navedenom djelatnom tvari.
2.8. Humani imunoglobulin (Octagam)
Odobrenje za stavljanje lijeka Octagam u promet bilo je suspendirano zbog povećanog broja prijavljenih tromboembolijskih događaja uključujući moždani udar, infarkt miokarda i plućnu emboliju) koji su bili potencijalno povezani s terapijom predmetnim lijekom te su uočeni kod kod pacijenata koji su ga primali.
Europska komisija je 04. listopada 2010. godine na prijedlog CHMP-a donijela obvezujuću odluku o privremenoj mjeri suspenzije odobrenja za stavljanje u promet lijeka Octagam u zemljama članicama Europske unije. HALMED je istovremeno povukao sve serije ovog lijeka i s hrvatskog tržišta.
Octagam intravenska otopina je indiciran kao nadomjesno liječenje kod sindroma primarne imunodeficijencije ili kod djece rođene sa stečenim sindromom imunodeficijencije (AIDS). Također se koristi kod ljudi s određenim poremećajima imunološkog sustava kao što je idiopatska trombocitopenična purpura (ITP) te u pacijenata kojima je transplantirana koštana srž.
Provedena je detaljna analiza svih dostupnih podataka o ranije identificiranim sigurnosnim i kvalitativnim problemima. CHMP zaključilo je kako je glavni uzrok tromboembolijskih događaja bila neočekivana prisutnost pro-koagulanta, faktora XIa te kako brojni kritični koraci u postupku proizvodnje mogu objasniti prisutnost tvari koje dovode do tromboembolijskih događaja.
Uvedene su brojne korektivne i preventivne mjere uključujući poboljšanje proizvodnog procesa te testiranje za otkrivanje faktora XIa ili drugih tvari, koje mogu uzrokovati tromboembolijske događaje, prije puštanja serija lijeka Octagam na tržište. Dodatno, nositelji odobrenja trebaju provesti sigurnosne post-marketinške studije čim lijek bude opet na tržištu kako bi se potvrdila sigurnost poboljšanog postupka proizvodnje.
U provedenu analizu bili su uključeni i inspekcijski nalazi s dva proizvodna mjesta. CHMP je uvjeren da će se buduća proizvodnja Octagama odvijati u skladu s postavljenim standardima kvalitete te je, stoga, predložilo ukidanje suspenzije u svibnju 2011. godine.
U Republici Hrvatskoj nije zabilježena niti jedna spontana prijava nuspojave, niti u sklopu mjera pojačanog nadzora za navedeni lijek u listopadu 2010. godine. HALMED je donio odluku o vraćanju novih serija lijeka Octagam na hrvatsko tržište u lipnju 2011. godine. Prilikom primjene lijeka u bolničkim ustanovama i dalje će se provoditi intenzivan nadzor, što osigurava sigurnu primjenu ovog lijeka kod svakog individualnog pacijenta.
2.9. Bevacizumab (Avastin)
Kod primjene Avastina prijavljeni su slučajevi osteonekroze čeljusti, od kojih se većina pojavila tijekom primjene kemoterapije uz istovremeno ili prethodno liječenje bisfosfonatima. Pojava osteonekroze čeljusti povezana je s liječenjem bisfosfonatima. Bisfosfonati imaju vrlo dugo vrijeme poluživota i mogu ostati aktivni u koštanom tkivu više mjeseci nakon prestanka liječenja. Avastin ima protivan učinak na angiogenezu, a taj se mehanizam trenutačno istražuje radi utvrđivanja potencijalnog utjecaja na klinički tijek osteonekroze čeljusti. Mnogi od tih bolesnika bili su liječeni istovremeno i drugim metodama koje su poznati faktori rizika za osteonekrozu / osteonekrozu čeljusti (npr. radioterapija, glukokortikoidi).
Liječenje Avastinom može biti dodatni faktor rizika za razvoj osteonekroze čeljusti. Ovaj potencijalni rizik treba osobito uzeti u obzir kod istovremene ili uzastopne primjene Avastina i bisfosfonata. Kao faktor rizika također su prepoznati invazivni stomatološki zahvati, te se pregled zuba i odgovarajući preventivni stomatološki zahvati moraju uzeti u obzir prije liječenja Avastinom. U bolesnika koji su prethodno primili ili intravenski primaju bisfosfonate treba izbjegavati invazivne stomatološke zahvate, ako je moguće.
Na temelju novih činjenica i spoznaja upućeno je pismo liječnicima propisivačima s novim podacima o povezanosti primjene lijeka Avastin (bevacizumab) sa slučajevima osteonekroze čeljusti u bolesnika koji boluju od maligne bolesti, a koji su istovremeno ili prethodno bili liječeni intravenski primijenjenim bisfosfonatima.
HALMED nastavlja pratiti sigurnost primjene bevacizumaba. HALMED je odobrio izmjenu Sažetka opisa svojstava lijeka (SPC) i Upute o lijeku (PIL) za lijek Avastin 25 mg/ml koncentrat otopine za infuziju kojom će se uključiti novi podaci vezani uz sigurnost primjene bevacizumaba.
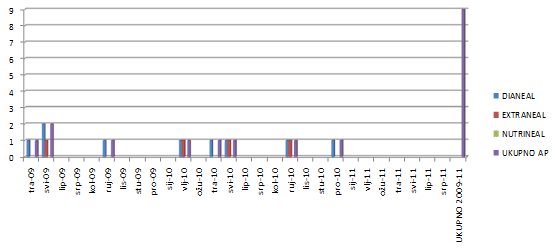
2.10. Otopine za peritonejsku dijalizu - Dianeal, Extraneal i Nutrineal
Proizvođač otopina za peritonejsku dializu (Baxter) je krajem 2010. godine ustanovio da neke vrećice serija otopina za peritonejsku dijalizu Dianeal, Extraneal i Nutrineal u Europskoj uniji sadrže povišene razine endotoksina koji mogu dovesti do upale potrbušnice (aseptički peritonitis) u pojedinih bolesnika. Samo mali broj vrećica je bio zahvaćen, ali nije bilo moguće ustanoviti o kojim se točno vrećicama radi. Neke od tih serija bile su distribuirane i u Republici Hrvatskoj. Aseptički peritonitis se manifestira bolovima u trbuhu i povišenom temperaturom, a u nekim slučajevima prolazi i bez kliničkih znakova već se utvrdi na temelju zamućene peritonejske otopine nakon peritonejske dijalize.
Iz preventivnih razloga sve potencijalno zahvaćene serije otopina za peritonejsku dijalizu postepeno su bile povučene s tržišta Republike Hrvatske i Europske unije uvođenjem zamjenskih serija kojima su bile zadovoljene potrebe tržišta, jer naglo povlačenje otopina dovelo bi u pitanje život tih bolesnika. U tijeku zamjene provodio se intenzivni postupak nadziranja i procjena rizika i koristi nastavka liječenja ovim otopinama za peritonejsku dijalizu koje su moguće bile zahvaćene ovim slučajem kako u Europskoj uniji, tako i u Republici Hrvatskoj pod nadzorom HALMED-a. Zamjenom zahvaćenih serija nije prestalo intenzivno praćenje u Republici Hrvatskoj, te donosimo prikaz zabilježenih nuspojava aseptičkog peritonitisa u Republici Hrvatskoj do početka srpnja 2011 godine koji nisu niti u jednom trenutku bili viši nego što je očekivani broj pri primjeni peritonejskih otopina:
Slika 20. Broj zaprimljenih slučajeva ASEPTIČNOG PERITONITISA u Hrvatskoj od 01/2009. do 07/2011.
2.11. Rivastigmin (Exelon, transdermalni flaster)
U 2010. godini u svijetu i Europskoj uniji prijavljeni su slučajevi medikacijskih pogrešaka i neodgovarajuće primjene Exelon transdermalnog flastera, od kojih su neki doveli do predoziranja rivastigminom. Simptomi predoziranja uključuju mučninu, povraćanje, proljev, hipertenziju i halucinacije. Neuklanjanje transdermalnog flastera i primjena više od jednog transdermalnog flastera u isto vrijeme Bio je prijavljen kao najčešći uzrok predoziranja.
Upućeno je pismo zdravstvenim radnicima o važnosti upućivanja bolesnika i skrbnika kako treba ispravno koristiti Exelon transdermalni flaster s posebnim naglaskom na sljedeće:
- samo jedan transdermalni flaster treba primijeniti svakog dana na zdravu kožu na jednom od preporučenih područja: gornji ili donji dio leda, nadlaktica ili prsa.
- transdermalni flaster treba zamijeniti novim nakon 24 sata, a flaster od prethodnog dana se mora ukloniti prije primjene novog flastera koji se stavlja na različito područje kože;
- kako bi se smanjila iritacija kože, treba izbjegavati primjenu flastera na istom području kože unutar 14 dana.
- Transdermalni flaster se ne smije rezati na komadiće!
2.12. Izotretionin (Roaccutane)
Tijekom 2010. godine postali su dostupni dodatni podaci o povezanosti primjene lijeka izotretionin (Roaccutane 10 mg meke kapsule) i teških kožnih reakcija (multiformni eritem, Stevens-Johnsonov sindrom i toksična epidermalna nekroliza) koji su zabilježeni u svijetu i zemljama Europske unije. Zbog uočenih reakcija preporučuje se pomni nadzor bolesnika kojima je propisan lijek Roaccutane (izotretionin )10 mg meke kapsule. Naglašeno je da pozornost pri liječenju treba usmjeriti na pravovremenu dijagnozu teških kožnih reakcija te trenutno prekinuti liječenje ukoliko se posumnja na razvoj istih.
Tijekom 2010. u Republici Hrvatskoj nije zaprimljena niti jedna prijava nuspojava teških kožnih reakcija za lijek izotretionin.
2.13. Tocilizumab (RoActemra)
Liječnicima koji propisuju lijek RoActemra (tocilizumab) upućeno je pismo s novim podacima o sigurnosti njegove primjene vezane uz prijavljeni slučaj anafilaksije sa smrtnim ishodom u bolesnika liječenog tocilizumabom iz svijeta.
U prijavljenom slučaju bolesnik je razvio reakciju preosjetljivosti tijekom prethodne infuzije tocilizumabom, te je do smrtnog slučaja došlo zbog anafilaksije nakon primjene sljedeće infuzije, iako je pacijent prethodno primio premedikaciju steroidima i antihistaminicima. Stoga zdravstveni radnici moraju biti oprezni vezano uz pojavu znakova preosjetljivosti ili anafilaksije u svih bolesnika koji primaju tocilizumab, tijekom i nakon njegove primjene. Za slučaj anafilaktičke reakcije tijekom liječenja RoActemrom mora biti dostupna odgovarajuća terapija za trenutnu primjenu. Ako se pojavi anafilaktička reakcija ili druga ozbiljna reakcija preosjetljivosti / ozbiljna infuzijska reakcija, potrebno je primjenu RoActemre odmah zaustaviti, započeti s odgovarajućim liječenjem a liječenje RoActemrom treba trajno prekinuti.
Klinički značajne reakcije preosjetljivosti / ozbiljne infuzijske reakcije povezane s tocilizumabom a koje zahtijevaju prestanak liječenja prijavljene su u 0,3% svih bolesnika koji su primali tocilizumab u kliničkim ispitivanjima. Te su reakcije u načelu zamijećene u razdoblju između primjene druge i pete infuzije tocilizumaba. Slučaj anafilaksije sa smrtnim ishodom prijavljen je tijekom liječenja tocilizumabom nakon stavljanja lijeka u promet.
HALMED nastavlja pratiti sigurnost primjene tocilizumaba. Agencija je odobrila izmjenu Sažetka opisa svojstava lijeka (SPC) i Upute o lijeku za lijek (PIL) RoActemra 20 mg/ml koncentrat za otopinu za infuziju kojom su uključeni novi podaci vezani uz sigurnost primjene tocilizumaba.
2.14. Sunitinib (Sutent)
Sutent (sunitinib) je lijek indiciran za liječenje neoperabilnog i/ili metastatskog gastrointestinalnog stromalnog tumora u odraslih nakon bezuspješnog liječenja imatinib mesilatom zbog rezistencije ili nepodnošljivosti, te za liječenje uznapredovalog i/ili metastatskog karcinoma bubrežnih stanica u odraslih.
U 2010. godini poslano je Pismo liječnicima propisivačima o novim podacima vezanim uz povezanost primjene lijeka Sutent kapsule sa slučajevima osteonekroze čeljusti u bolesnika koji boluju od maligne bolesti, a koji su istovremeno ili prethodno bili liječeni intravenski primijenjenim bisfosfonatima.
U bolesnika oboljelih od maligne bolesti prijavljeni su slučajevi pojave osteonekroze čeljusti povezani s liječenjem sunitinibom, od kojih je većina istovremeno ili prethodno bila liječena intravenskom primjenom bisfosfonata. Liječenje sunitinibom može biti dodatni čimbenik rizika za razvoj osteonekroze čeljusti. Pismom se liječnici propisivači upozoravaju kako ovaj potencijalni rizik treba osobito uzeti u obzir kod istovremene ili uzastopne primjene sunitiniba i bisfosfonata. Stomatološki pregled i odgovarajući preventivni stomatološki zahvati trebaju se uzeti u obzir prije liječenja sunitinibom. Kod bolesnika koji primaju ili su prethodno primili bisfosfonate intravenski treba izbjegavati invazivne stomatološke zahvate ako je moguće.
HALMED nastavlja pratiti sigurnost primjene lijekova djelatne tvari sunitinib. HALMED je odobrio izmjenu Sažetka opisa svojstava lijeka i Upute o lijeku za lijekove Sutent 12,5 mg kapsule, Sutent 25 mg kapsule, Sutent 37,5 mg kapsule i Sutent 50 mg kapsule kojom su uključeni novi podaci vezani uz sigurnost primjene sunitiniba.
2.15. Aprotinin (Tisseel)
Upućeno je Pismo liječnicima korisnicima o tehnici sprejanja uz regulator tlaka te o novim podacima vezanim uz sigurnost primjene lijeka Tisseel Lyo prašci i otapala za fibrinsko tkivno ljepilo.
U svijetu su zabilježeni slučajevi zračne ili plinske embolije koje su uočene prilikom korištenja fibrinskih tkivnih ljepila različitih proizvođača putem naprave za sprejanje uz regulator tlaka. Čini se da do navedenog događaja dolazi zbog korištenja naprave za sprejanje pri tlaku većem od preporučenog i/ili u neposrednoj blizini površine tkiva. Stoga, nositelj odobrenja ovim pismom liječnicima korisnicima tehnike sprejanja uz regulator tlaka pruža dodatne upute kako bi se spriječio nastanak zračne ili plinske embolije.
Potrebna upozorenja i podaci vezani uz sigurnost primjene uključena su u Sažetak opisa svojstava lijeka i Uputu o lijeku. HALMED nije zabilježio niti jedan slučaj embolije u Republici Hrvatskoj kod primjene predmetnog lijeka te će nastaviti pratiti sigurnost primjene istog.





