Izvješće o nuspojavama u 2013. godini
- 1. Uvod
- 2. Prijave nuspojava u 2013. godini
- 2.1. Izvori prijava
- 2.2. Karakteristike prijava nuspojava lijekova i cjepiva
- 2.2.1. Klasifikacija lijekova
- 2.2.2. Dob i spol bolesnika
- 2.2.3. Vrste nuspojava
- 2.2.4. Broj lijekova u istovremenoj primjeni
- 2.2.5. Ozbiljnost nuspojave
- 2.2.6. Ishod nuspojave
- 2.2.7. Nuspojave po organskim sustavima
- 2.2.8. Najčešće prijavljene nuspojave u 2013. godini
- 3. Pregled sigurnosnih pitanja u 2013. godini
- 3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2013. godini
- 3.1.1. Kombinirani hormonski kontraceptivi treće i četvrte generacije
- 3.1.2. Lijekovi koji sadrže ciproteronacetat i etinilestradiol
- 3.1.3. Lijekovi za sistemsku primjenu koji sadrže diklofenak
- 3.1.4. Otopine za infuziju koje sadrže hidroksietil škrob (HES)
- 3.1.5. Lijekovi koji sadrže kalcitonin
- 3.1.6. Lijekovi koji sadrže stroncijev ranelat
- 3.1.7. Lijekovi za oralnu primjenu koji sadrže ketokonazol
- 3.1.8. Kratkodjelujući beta-agonisti
- 3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2013. godini
- 3.2.1. Novosti u prijavljivanju nuspojava i regulatornim aktivnostima vezanim uz sigurnost primjene lijekova nakon ulaska Republike Hrvatske u Europsku uniju
- 3.2.2. Javna edukativna kampanja za promicanje važnosti čitanja upute o lijeku i prijavljivanja nuspojava na lijekove
- 4. Zaključak
1. Uvod
Na temelju Zakona o lijekovima (Narodne novine, br. 73/13.) i pripadajućeg Pravilnika o farmakovigilanciji (Narodne novine, br. 83/13.) Agencija za lijekove i medicinske proizvode - HALMED (u daljnjem tekstu HALMED) prati nuspojave zabilježene u Republici Hrvatskoj koje su zdravstveni radnici i nositelji odobrenja za stavljanje gotovog lijeka u promet obvezni prijavljivati. HALMED također zaprima izravne prijave nuspojava lijekova od pacijenata. HALMED prati nuspojave lijekova iz prometa i nuspojave zabilježene u kliničkim ispitivanjima.
Ovo je deveto (9.) izvješće o prijavama nuspojava zaprimljenima iz Republike Hrvatske koje je izradio HALMED.
2. Prijave nuspojava u 2013. godini
Tijekom 2013. godine HALMED je zaprimio ukupno 2491 prijavu sumnje na nuspojavu u Republici Hrvatskoj.
Ukupan broj prijava nuspojava u 2013. godini u Republici Hrvatskoj čini zbroj:
- spontanih prijava nuspojava lijekova zaprimljenih u HALMED-u:
-
- spontane prijave nuspojava izravno prijavljene HALMED-u od strane zdravstvenih radnika
- nuspojave proslijeđene HALMED-u od nositelja odobrenja za stavljanje gotovog lijeka u promet koje su zaprimili od zdravstvenih radnika ili pacijenata
- prijave nuspojava izravno prijavljene HALMED-u od strane pacijenata/korisnika lijeka
- spontanih prijava nuspojava cjepiva zaprimljenih u HALMED-u:
-
- prijave nuspojava na cjepiva koje zaprima Hrvatski zavod za javno zdravstvo (HZJZ) i prosljeđuje HALMED-u
- prijave nuspojava cjepiva koje je HALMED izravno primio od zdravstvenih radnika, nositelja odobrenja ili pacijenata
- prijava nuspojava dodataka prehrani
- ukupnog broja sumnji na ozbiljne neočekivane nuspojave (SUSAR) iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj.
Broj prijava iz svake od navedenih skupina prikazan je u Tablici 1, a njihov udio na Slici 1.
Tablica 1. Prijave nuspojava po skupinama proizvoda (ukupan broj)
| Skupine | Lijekovi | Cjepiva | Dodaci prehrani | SUSAR* | UKUPNO |
|---|---|---|---|---|---|
| Broj prijava | 2223 | 189 | 13 | 66 | 2491 |
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Slika 1. Udio prijava nuspojava po skupinama proizvoda
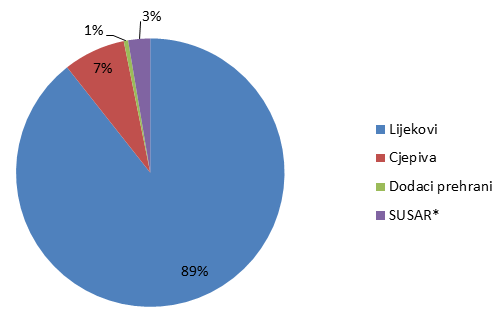
*sumnja na ozbiljnu neočekivanu nuspojavu iz kliničkih ispitivanja koja se provode u Republici Hrvatskoj
Tijekom 2013. godine HALMED je zaprimio ukupno 2491 prijavu sumnje na nuspojavu u Republici Hrvatskoj. Od tog broja, 25 prijava je prikupljeno iz objavljenih literaturnih podataka o nuspojavama zabilježenima u RH, 196 prijava je proizašlo iz kliničkih ispitivanja ili postmarketinških neintervencijskih ispitivanja, dok su 1784 prijave prikupljene spontanim prijavljivanjem nuspojava od strane zdravstvenih radnika i pacijenata izravno HALMED-u, preko nositelja odobrenja za stavljanje gotovog lijeka u promet ili od Hrvatskog zavoda za javno zdravstvo. Ukupno 142 prijave nuspojava lijekova zaprimljene su od pacijenata/korisnika lijeka/zakonskih zastupnika koji su sumnju na nuspojavu prijavili izravno HALMED- u.
Ključni zaključci razmatranja dobivenih podataka su sljedeći:
- Ukupan broj prijava zabilježio je rast od 30% u odnosu na 2012. godinu (2491 prijava prema 1923 u 2012. godini)
- Pedeset i pet posto (55%) svih prijava sumnji na nuspojave u 2013. godini ishodište je imalo od strane liječnika, što je manje nego u 2012. godini, kad su liječnici bili izvor 63% prijava.
- Nastavlja se trend porasta broja prijava od strane ljekarnika, koji u 2013. godini iznosi 34% prijava (naprema 30% u 2012., 24% u 2011., odnosno 20% u 2010. godini)
- Broj prijava zaprimljenih od strane pacijenata u 2013. godini je 142, što čini udio od gotovo 6% svih prijava (u 2012. godini taj je udio iznosio nešto više od 2%)
- Među pošiljateljima prijava HALMED-u, zabilježen je blagi pad u udjelu nositelja odobrenja za stavljanje lijeka u promet u odnosu na 2012. godinu i iznosi 29% (u 2012. godini taj je udio iznosio 34%)
- U 2013. godini osjetno je veći broj prijava za nuspojave koje ne udovoljavaju kriterijima ozbiljne nuspojave (66% ne-ozbiljnih prema tek 34% ozbiljnih nuspojava; u 2012. godini taj odnos je bio 56% - 44%).
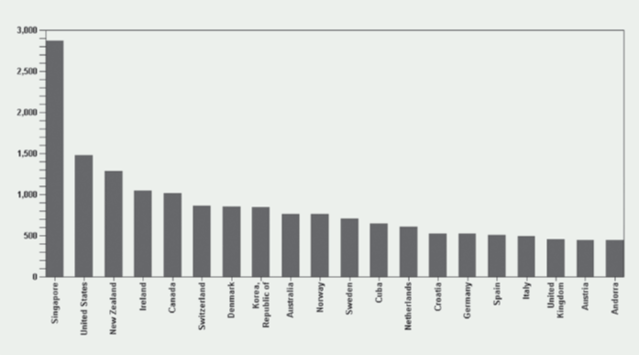
Kao što je naglašavano u Izvješćima iz prethodnih godina, broj prijava sumnji na nuspojave je indikator kvalitete samog sustava prijavljivanja nuspojava. Zahvaljujući zajedničkim naporima HALMED-a i svih zdravstvenih radnika, pacijenata i nositelja odobrenja za lijekove koji redovito prijavljuju sumnje na nuspojave, Republika Hrvatska se, po kvaliteti i broju prijava nuspojava, izraženo na milijun stanovnika, u 2013. godini popela za dva mjesta na ljestvici u odnosu na 2012. godinu te se nalazi na visokom 14. mjestu od 115 zemalja svijeta koje sudjeluju u programu praćenja sigurnosti lijekova Svjetske zdravstvene organizacije (WHO). Republika Hrvatska je po broju i kvaliteti prijava pretekla čak i Veliku Britaniju - zemlju kolijevku spontanog prijavljivanja nuspojava u svijetu!
Slika 2. preuzeta je iz publikacije (Uppsala Reports (br. 63, listopad 2013. godine), koju izdaje Uppsala Monitoring Centre (UMC), centar za praćenje nuspojava WHO-a.
Slika 2. Broj prijava nuspojava na milijun stanovnika u bazi Svjetske zdravstvene organizacije (Uppsala Monitoring Centre - VigiBase), rujan 2008. - rujan 2013. godine
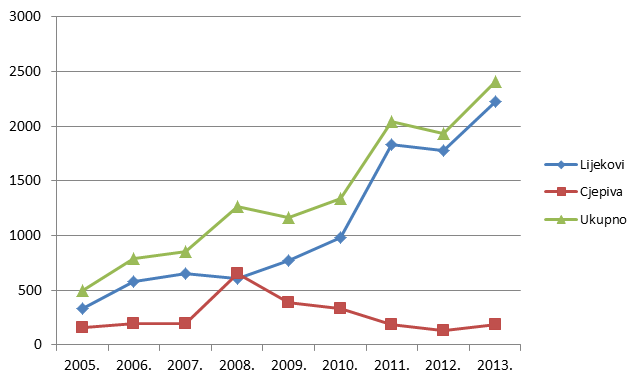
Tablica 2. Kretanje ukupnog broja prijava nuspojava (uključujući SUSAR) u Republici Hrvatskoj u posljednjih devet godina (2005. - 2013.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. | 2013. |
|---|---|---|---|---|---|---|---|---|---|
| Ukupan broj prijava nuspojava | 498 | 790 | 856 | 1265 | 1165 | 1338 | 2040 | 1923 | 2491 |
Tablica 3. Kretanje ukupnog broja prijava nuspojava (uključujući SUSAR) u Republici Hrvatskoj u posljednjih devet godina (2005. - 2013.)
| Godina | 2005. | 2006. | 2007. | 2008. | 2009. | 2010. | 2011. | 2012. | 2013. |
|---|---|---|---|---|---|---|---|---|---|
| Lijekovi | 336 | 579 | 655 | 611 | 776 | 983 | 1831 | 1737 | 2223 |
| Cjepiva | 162 | 194 | 192 | 654 | 389 | 331 | 191 | 129 | 189 |
Slika 3. Kretanje broja prijava nuspojava u Republici Hrvatskoj u posljednjih devet godina (2005. - 2013.)
U 2013. godini HALMED je nastavio održavati radionice za zdravstvene radnike i odgovorne osobe za farmakovigilanciju nositelja odobrenja putem kojih ih educira o njihovoj ulozi u farmakovigilancijskom sustavu u Republici Hrvatskoj te o načinu i značaju prijavljivanja sumnji na nuspojave. Održana je jedna radionica na kojoj je sudjelovalo ukupno 27 polaznika. Od rujna 2005. do kraja 2013. godine HALMED je održao ukupno 90 radionica iz područja farmakovigilancije koje je pohađalo i uspješno završilo gotovo 1600 zdravstvenih radnika.
2.1. Izvori prijava
Najzastupljenija skupina prijavitelja tradicionalno su liječnici, koji su u 2013. godini prijavili 55% svih prijava sumnji na nuspojave. U ovoj je skupini ipak zabilježen blagi pad u odnosu na 2012. godinu, kada je ukupno 63% prijava imalo ishodište od strane liječnika.
S druge strane, nastavlja se trend porasta broja prijava od strane ljekarnika, koji u 2013. godini iznosi 34% prijava (naprema 30% u 2012., 24% u 2011., odnosno 20% u 2010. godini) (Slika 6.). Ta činjenica odražava se na brojne parametre koji se prate u Izvješću, a o čemu će biti riječi u daljnjem tekstu. Svaka skupina prijavitelja ima svoje karakteristike, a zadaća je HALMED-a svima olakšati prijavljivanje te osigurati ravnomjernu zastupljenost svih skupina kako bi se mogao steći sveobuhvatan uvid u stvarno stanje sigurnosti primjene lijekova na hrvatskom tržištu.
Velika novost u 2013. godini je i gotovo trostruki porast broja prijava od strane pacijenata u odnosu na prethodnu godinu. Tijekom 2013. godine, HALMED je zaprimio 142 prijave od pacijenata/korisnika lijeka ili njihovih zakonskih zastupnika (Tablica 4.). Prijavljivanje od strane pacijenata/korisnika lijekova ili njihovih zakonskih zastupnika omogućeno je u RH prvenstveno Pravilnikom o farmakovigilanciji iz 2009. godine, a potom i novim Pravilnikom o farmakovigilanciji iz 2013. godine, u kojem je implementirano novo europsko farmakovigilancijsko zakonodavstvo iz 2012. godine. Navedenim zakonodavstvom od država članica se zahtijeva da omoguće izravno prijavljivanje nuspojava regulatornom tijelu. Prijavljivanje od strane pacijenata/korisnika lijekova ili njihovih zakonskih zastupnika u RH osobito je olakšano implementacijom aplikacije UMC-a u 2012. godini namijenjene upravo za navedenu svrhu. HALMED je tijekom rujna i listopada 2013. godine na nacionalnoj razini proveo javnu edukativnu kampanju namijenjenu promicanju važnosti čitanja upute o lijeku i prijavljivanja nuspojava među pacijentima i korisnicima lijekova. Izravan utjecaj provođenja kampanje uočljiv je u posljednjem kvartalu prošle godine kad je HALMED zaprimio ukupno 813 prijava. Zanimljivo je da kampanja nije potaknula samo pacijente na prijavljivanje već je u istom razdoblju zabilježen i povećan broj prijava od strane zdravstvenih radnika. Dodatno, umjesto očekivanog pada broja prijava nakon završetka kampanje, kampanja je ostvarila trajniji utjecaj na prijavljivanje od strane pacijenata; u prvom kvartalu ove godine HALMED je zaprimio 40 njihovih prijava, što ukazuje na to da bi i u 2014. godini mogao biti prikupljen sličan broj prijava od strane pacijenata.
Ono što se i dalje ne vidi je značajniji rast prijava nuspojava od strane medicinskih sestara odnosno tehničara. Neprijavljivanje nuspojava s njihove strane i dalje ostaje nejasno s obzirom na to da se radi o zdravstvenim radnicima koji imaju zakonsku obvezu prijavljivanja, a u svakodnevnom su bliskom kontaktu s pacijentima - posebno u bolničkim uvjetima gdje su uključeni u dnevnu podjelu terapije. Iako je na radionicama o prijavljivanju nuspojava koje za zdravstvene radnike organizira HALMED sudjelovao i značajni broj bolničkih medicinskih sestara, najvjerojatnije zbog tradicionalnog stava da samo liječnici "smiju" prijaviti nuspojavu, sustav je i dalje bez prijava sestara. S obzirom na to da i pacijenti sami imaju priliku izravno prijaviti sumnju na nuspojavu, očekujemo pozitivan trend u sljedećim godinama, posebno nakon uvođenja informatičkih aplikacija u bolnice koje će omogućiti brže izravnije prijavljivanje HALMED-u.
Slika 4. Kretanje broja prijava od strane zdravstvenih radnika i pacijenta u 2013. godini
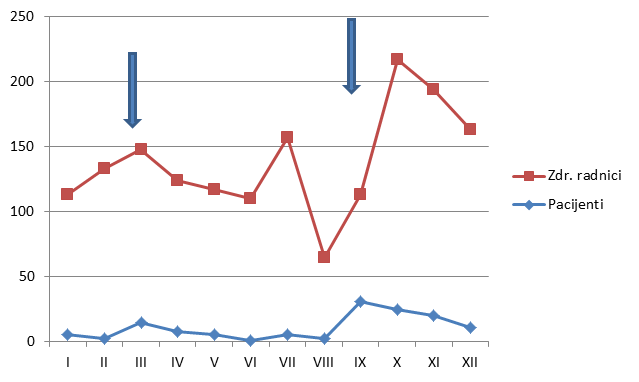
Slika 4. prikazuje usporedno kretanje broja prijava u 2013. godini za zdravstvene radnike i pacijente. Prisutna su ukupno četiri vrhunca; tijekom ožujka, što se podudara s pojačanim interesom za prijavu sumnji na nuspojave zbog medijske pozornosti izazvane objavom godišnjeg izvješća o nuspojavama; tijekom srpnja za zdravstvene radnike prije odlaska na godišnje odmore (vjerojatno zbog slanja "zaostalih" prijava prikupljenih tijekom ranijih mjeseci); tijekom rujna za pacijente (osobito posljednja dva tjedna), što se podudara s provedbom javne edukativne kampanje, te tijekom listopada, kada je uočljiv vrhunac utjecaja kampanje na prijavljivanje od strane zdravstvenih radnika (početak distribucije promotivnih materijala u ordinacijama i ljekarnama).
HALMED je u 2013. godini zaprimio 720 prijava od strane nositelja odobrenja za stavljanje gotovog lijeka u promet, što čini 29% ukupnog broja prijava i pokazuje da nositelji odobrenja ozbiljno shvaćaju svoju ulogu u praćenju i nadziranju sigurnosnog profila svojih lijekova na tržištu.
Tablica 4. Izvori prijava sumnji na nuspojave lijekova i cjepiva u 2013. godini prema struci prijavitelja
| Izvor prijave | Broj prijava |
|---|---|
| Liječnik (bez specijalizacije ili specijalizacija nije navedena) | 571 |
| Liječnici specijalisti (ukupno) | 590 |
| Specijalist obiteljske medicine | 154 |
| Pedijatar | 80 |
| Specijalist školske medicine | 61 |
| Psihijatar | 56 |
| Internist | 38 |
| Dermatovenerolog | 24 |
| Reumatolog | 24 |
| Epidemiolog | 19 |
| Radiolog | 15 |
| Ginekolog | 14 |
| Infektolog | 13 |
| Nefrolog | 13 |
| Pulmolog | 12 |
| Klinički farmakolog | 10 |
| Neurolog | 10 |
| Endokrinolog | 9 |
| Gastroenterolog | 9 |
| Anesteziolog | 5 |
| Spec. nuklearne medicine | 5 |
| Kardiolog | 4 |
| Onkolog | 4 |
| Spec. medicine rada | 4 |
| Transfuziolog | 4 |
| Oftalmolog | 2 |
| Otorinolaringolog | 1 |
| Farmaceuti | 844 |
| Medicinske sestre | 7 |
| Medicinski i farmaceutski tehničari | 1 |
| Nepoznat izvor (≈zdravstveni radnici nepoznatog profila) | 336 |
| Pacijenti | 142 |
| UKUPNO: | 2491 |
Slika 5. Kretanje broja prijava po izvorima prijavitelja u razdoblju od 2005. do 2013. godine

U kategoriji "nepoznat izvor prijave" Slika 5. i Tablica 4. poznato je da se radi o zdravstvenim radnicima, ali nije poznat njihov profil (liječnik, farmaceut itd.). Radi se o kategoriji koja se najčešće javlja kod prijava nositelja odobrenja te se na taj način objašnjava i porast broja prijavitelja u navedenoj kategoriji "nepoznat izvor prijave" tijekom zadnje četiri godine, što korelira s povećanim brojem prijava od strane nositelja odobrenja posljednjih nekoliko godina.
Slika 6. Udio prijava prema strukama zdravstvenih radnika prijavitelja u razdoblju od 2005. do 2013. godine
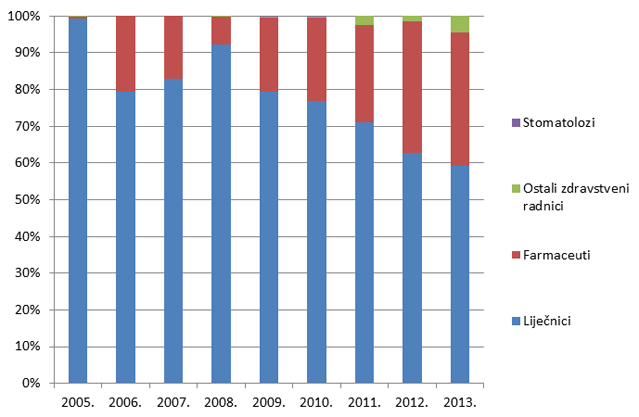
Slika 6. pokazuje udio pojedinih zdravstvenih radnika u prijavljivanju nuspojava u kojem tradicionalno dominiraju liječnici. Od 2008. godine, udio prijava od strane farmaceuta raste i trenutno čini 34% svih prijavljenih nuspojava. Prijave od strane medicinskih tehničara, farmaceutskih tehničara i stomatologa su, nažalost, još uvijek malobrojne stoga HALMED planira dodatne edukacije navedenih zdravstvenih radnika u svrhu poticanja prijavljivanja nuspojava.
Udio broja prijava iz bolničkih ustanova u 2013. godini iznosio je 11% (Tablica 5.). Budući da za više od 800 prijava nije točno specificirana ustanova iz koje je nuspojava prijavljena, vjerojatno je da se neke nuspojave iz bolnica kriju u ovim prijavama. HALMED smatra kako je trenutni broj prijava iz bolničkih ustanova premali. Kao rješenje za postojeće stanje, nameće se potreba za integracijom sustava za prijavu nuspojava u bolničke informatičke sustave, kao i za dodatnom edukacijom o potrebi prijavljivanja nuspojava. Nuspojave iz bolničkih ustanova su od osobitog značaja jer obično produžuju hospitalizaciju ili dovode do hospitalizacije pa time uvijek pripadaju kategoriji ozbiljnih nuspojava.
Tablica 5. Izvori spontanih prijava sumnji na nuspojave prema zdravstvenim ustanovama u 2013. godini
| Ustanova | Broj prijava |
|---|---|
| Ljekarna | 789 |
| Ordinacija obiteljske medicine | 378 |
| Klinička bolnica ili klinički bolnički centar | 149 |
| Opća bolnica | 107 |
| Zavod za javno zdravstvo | 92 |
| Pedijatrijska ordinacija | 52 |
| Specijalna bolnica | 34 |
| Ostalo | 40 |
| Nepoznato | 850 |
| UKUPNO PRIJAVA: | 2491 |
Slika 7. Udio pojedinih ustanova kao izvora prijavljivanja nuspojava u 2013. godini
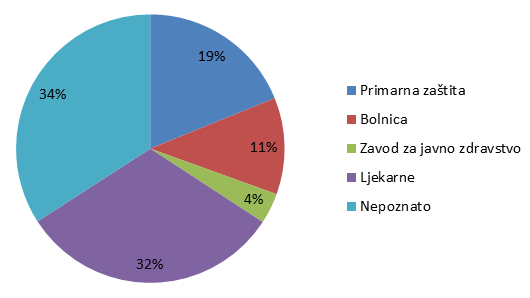
Slika 7. prikazuje udio pojedinih ustanova u prijavljivanju nuspojava. Pod kategorijom Primarna zdravstvena zaštita uključene su prijave zaprimljene iz ordinacija obiteljske medicine, ginekoloških i pedijatrijskih ordinacija, dok su kategorijom Bolnica obuhvaćene sve vrste bolnica i bolničkih centara. Posebno su izdvojeni zavodi za javno zdravstvo, koji su važni u sustavu prijavljivanja nuspojava cjepiva, te ljekarne. Ukupno 32% ustanova nije identificirano kroz prijavu, što je nešto manje u odnosu na 2012. godinu. Navedeno je posljedica povećanog broja prijava od strane nositelja odobrenja, u kojima ova informacija u određenim slučajevima nedostaje zbog toga što elektronički sustavi pojedinih nositelja odobrenja ne prosljeđuju navedenu informaciju. HALMED radi na otklanjanju ovog problema jer bitno utječe na kvalitetu sustava i planiranje aktivnosti za njegovo unapređenje.
Tijekom 2013. godine putem on-line aplikacije za prijavu nuspojava dostupne na HALMED-ovim internetskim stranicama zaprimljeno je 266 prijava. Iako je navedena aplikacija namijenjena prvenstveno pacijentima, često je koriste i zdravstveni radnici; od 266 prijava zaprimljenih putem aplikacije, 184 su poslali zdravstveni radnici, a 82 pacijenti ili zakonski zastupnici/skrbnici.
HALMED je i u 2013. godini iz svake županije zaprimio barem jednu prijavu sumnje na nuspojavu. Najviše prijava zaprimljeno je s područja Grada Zagreba - 1392. Slijede Splitsko- dalmatinska sa 158 prijava i Osječko-baranjska županija sa 132 prijave.
Tablica 6. Broj prijava nuspojava po županijama u 2013. godini
| Županija | Broj prijava u 2013. godini | Broj prijava na 10.000 stanovnika u 2013. godini |
|---|---|---|
| I. Zagrebačka | 82 | 2,6 |
| II. Krapinsko-zagorska | 36 | 2,8 |
| III. Sisačko-moslavačka | 84 | 4,9 |
| IV. Karlovačka | 27 | 2,1 |
| V. Varaždinska | 42 | 2,4 |
| VI. Koprivničko-križevačka | 54 | 4,7 |
| VII. Bjelovarsko-bilogorska | 54 | 4,5 |
| VIII. Primorsko-goranska | 92 | 3,1 |
| IX. Ličko-senjska | 13 | 2,6 |
| X. Virovitičko-podravska | 13 | 1,5 |
| XI. Požeško-slavonska | 12 | 1,5 |
| XII. Brodsko-posavska | 38 | 2,4 |
| XIII. Zadarska | 65 | 3,8 |
| XIV. Osječko-baranjska | 132 | 4,4 |
| XV. Šibensko-kninska | 19 | 1,7 |
| XVI. Vukovarsko-srijemska | 28 | 1,6 |
| XVII. Splitsko-dalmatinska | 158 | 3,5 |
| XVIII. Istarska | 92 | 4,4 |
| XIX. Dubrovačko-neretvanska | 32 | 2,7 |
| XX. Međimurska | 39 | 3,5 |
| XXI. Grad Zagreb | 1392 | 17,6 |
| UKUPNO PRIJAVA: | 2491 | 5,8 |
Prosječan broj prijava izražen na 10.000 stanovnika za cijelu Republiku Hrvatsku u 2013. godini iznosio je 5,8 prijava. U odnosu na prosjek Republike Hrvatske, samo Grad Zagreb bilježi iznadprosječni rezultat, dok su sve druge županije ispod državnog prosjeka. Razlog velikog broja prijava iz Grada Zagreba može se pronaći u činjenici da se sjedišta velikog broja nositelja odobrenja nalaze upravo u Zagrebu.
Na temelju ovih podataka HALMED će i dalje planirati održavanje radionica o ulozi zdravstvenih radnika u farmakovigilancijskom sustavu Republike Hrvatske.
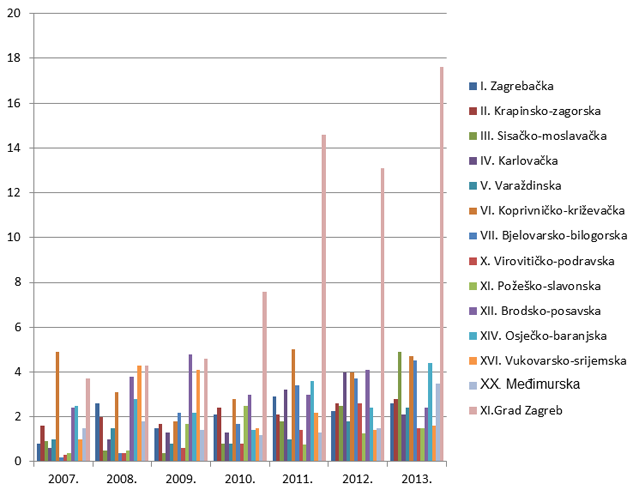
Slika 8. Broj prijava na 10.000 stanovnika po županijama za razdoblje od 2007. do 2013. godine (kontinentalna Hrvatska)
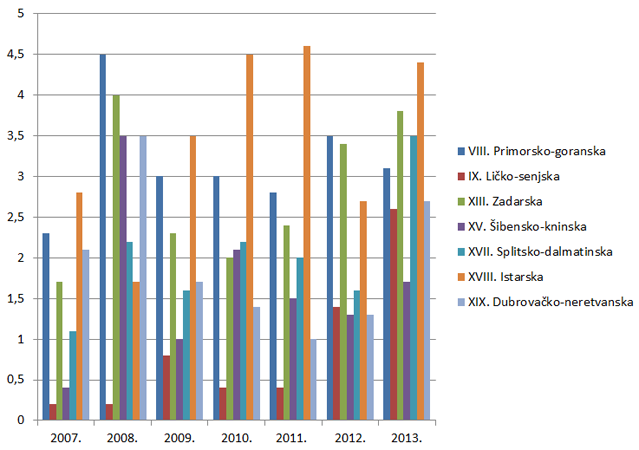
Slika 9. Broj prijava na 10.000 stanovnika po županijama za razdoblje od 2007. do 2013. godine (Jadranska Hrvatska)
2.2. Karakteristike prijava nuspojava lijekova i cjepiva
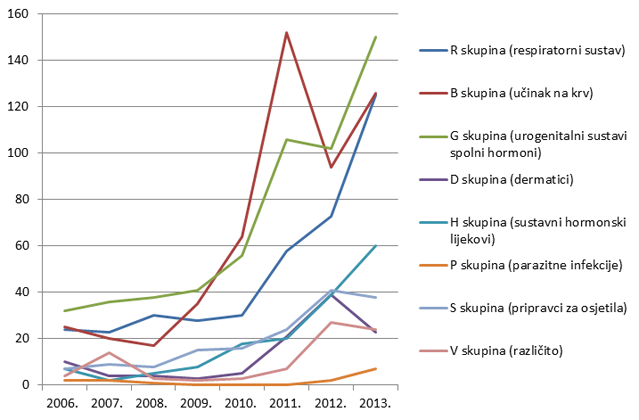
Tri najzastupljenije skupine lijekova prema broju prijava sumnji na nuspojave za 2013. godinu su skupine C (lijekovi za liječenje bolesti kardiovaskularnog sustava), J (lijekovi za liječenje sustavnih infekcija i cjepiva) i N (lijekovi za liječenje bolesti živčanog sustava). Dok su skupine C i J zabilježile znatan porast broja prijava, za lijekove iz skupine N zabilježen je za trećinu manji broj prijava u odnosu na 2012. godinu. Ukupan broj lijekova za koje je prijavljena sumnja na nuspojavu veći je od ukupnog broja prijava jer se u jednoj prijavi mogu naznačiti sumnje na nuspojave više lijekova (Tablica 7.).
Tablica 7. Apsolutni broj lijekova za koje je u 2013. godini prijavljena sumnja na nuspojave prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji
| ATK klasifikacija | 2013. |
|---|---|
| ATK 1. razina A skupina (probavni sustav) | 225 |
| ATK 1. razina B skupina (učinak na krv) | 126 |
| ATK 1. razina C skupina (kardiovaskularni sustav) | 622 |
| ATK 1. razina D skupina (dermatici) | 23 |
| ATK 1. razina G skupina (urogenitalni sustavi spolni hormoni) | 150 |
| ATK 1. razina H skupina (sustavni hormonski lijekovi) | 60 |
| ATK 1. razina J skupina (liječenje sustavnih infekcija) | 576 |
| ATK 1. razina L skupina (citostatici) | 334 |
| ATK 1. razina M skupina (koštano-mišićni sustav) | 117 |
| ATK 1. razina N skupina (živčani sustav) | 410 |
| ATK 1. razina P skupina (parazitne infekcije) | 7 |
| ATK 1. razina R skupina (respiratorni sustav) | 125 |
| ATK 1. razina S skupina (pripravci za osjetila) | 38 |
| ATK 1. razina V skupina (različito) | 24 |
| UKUPNO LJEKOVA: | 2837 |
Slika 10. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2013. godine za najzastupljenije skupine lijekova

Slika 11. Kretanje broja prijava sumnji na nuspojave za pojedine skupine lijekova prema Anatomsko-Terapijsko-Kemijskoj (ATK) klasifikaciji u razdoblju od 2006. do 2013. godine za manje zastupljene skupine lijekova
Tablica 8. Broj prijava po ATK skupinama lijekova i prijavljivačima u 2013. godini
| Mjesto po broju prijava po ATK skupinama | Liječnici | Farmaceuti | Pacijenti | |||
|---|---|---|---|---|---|---|
| Skupina | Broj prijava | Skupina | Broj prijava | Skupina | Broj prijava | |
| 1. | J | 350 | C | 327 | J | 32 |
| 2. | L | 233 | J | 141 | C | 31 |
| 3. | C | 231 | N | 116 | N | 20 |
Liječnici i pacijenti najčešće prijavljuju nuspojave za lijekove iz ATK skupine J (lijekovi za liječenje sustavnih infekcija i cjepiva), dok farmaceuti najčešće prijavljuju nuspojave za lijekove iz ATK skupine C (lijekovi za liječenje bolesti srca i krvnih žila). Liječnici vrlo često prijavljuju nuspojave iz ATK skupine L (citostatici), što bi moglo biti jedno od objašnjenja značajno većeg broja ozbiljnih prijava nuspojava od strane liječnika u odnosu na farmaceute.
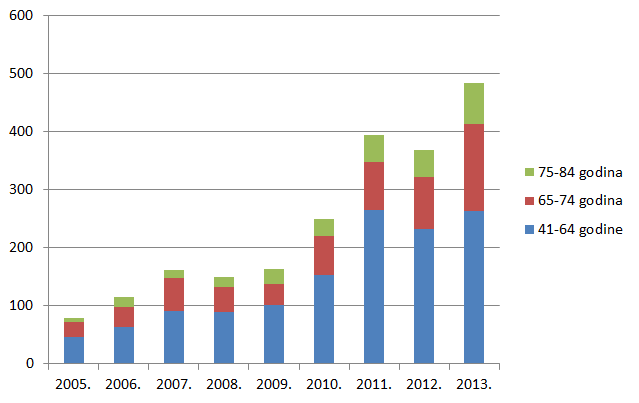
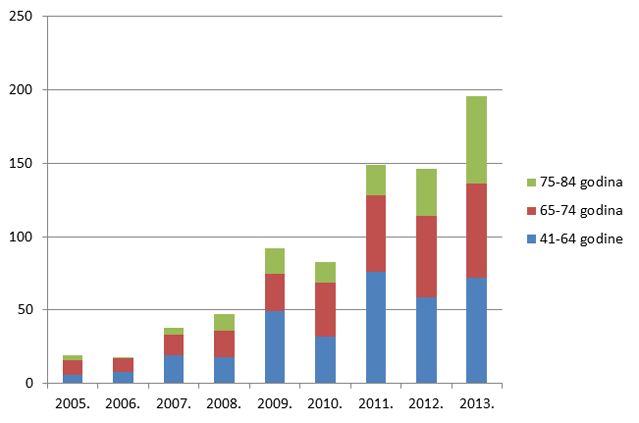
Kako pokazuje Tablica 9., broj prijava sumnji na nuspojave u mlađim dobnim kategorijama porastao je za sve mlađe dobne kategorije, prvenstveno zbog porasta broja prijava nuspojava cjepiva. Izrazit je porast broja prijava sumnji na nuspojave u dobnim skupinama od 65 do 74 godine te od 75 do 84 godine, dok je za gotovo 30% posto manje prijava za dobnu skupinu od 18 do 40 godina.
Tablica 9. Prijave sumnji na nuspojave lijekova prema dobi bolesnika u 2013. godini
| Dob bolesnika | Broj prijava u 2013. godini | Broj prijava u 2012. godini |
|---|---|---|
| Do 12 mjeseci | 32 | 16 |
| 1 do 2 godine | 34 | 22 |
| 3 do 6 godina | 67 | 36 |
| 7 do 14 godina | 105 | 71 |
| 15 do 17 godina | 35 | 17 |
| 18 do 40 godina | 352 | 493 |
| 41 do 64 godine | 781 | 749 |
| 65 do 74 godina | 451 | 271 |
| 75 do 84 godina | 269 | 170 |
| 85 godina i starije | 44 | 18 |
| Neupisana dob | 321 | 98 |
| UKUPNO: | 2491 | 1961 |
Ukupno gledajući, sumnje na nuspojave u 2013. godini prijavljivane su za bitno stariju populaciju u odnosu na onu iz 2012. godine. Veći je broj i prijava iz kojih nije bilo moguće saznati točnu dob pacijenta, što je izazov u smislu povećavanja kvalitete prijava koje HALMED zaprima.
Slika 12. Pregled kretanja broja prijava za mlađe dobne kategorije u razdoblju od 2008. do 2013. godine
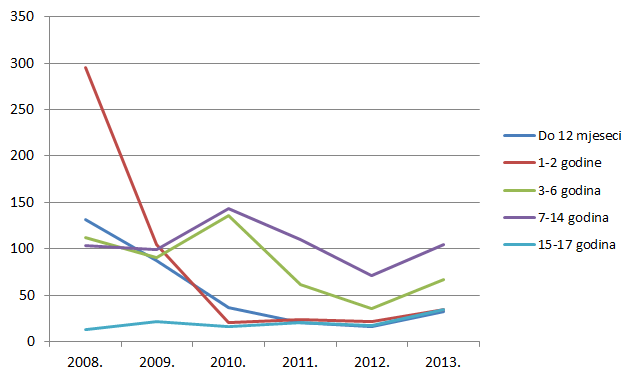
Slika 13. Pregled kretanja broja prijava za starije dobne kategorije u razdoblju od 2008. do 2013. godine

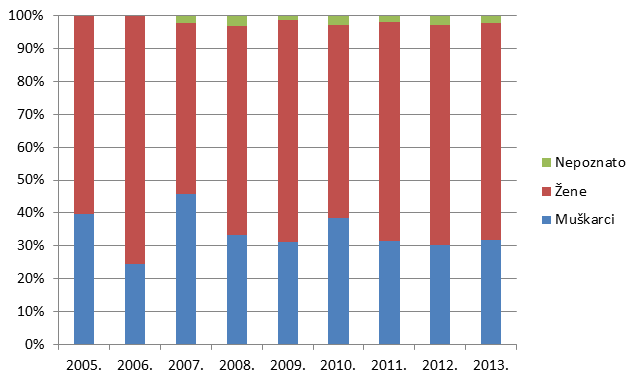
Tablica 10. Prijave sumnji na nuspojavu prema spolu bolesnika (usporedba s podacima iz 2012. godine)
| Spol | Broj prijava u 2013. godini | Broj prijava u 2012. godini | % u 2013. godini | % u 2012. godini |
|---|---|---|---|---|
| Muškarci | 945 | 716 | 38 | 37 |
| Žene | 1462 | 1155 | 59 | 60 |
| Nepoznato | 84 | 52 | 3 | 3 |
| UKUPNO: | 2491 | 1923 | 100 | 100 |
Slika 14. Prijava sumnji na nuspojave po spolu bolesnika u 2013. godini

Statistika koju HALMED vodi za sumnje na nuspojave lijekova već devetu godinu zaredom pokazuje da je veći broj prijava sumnji na nuspojavu zabilježen kod osoba ženskog spola.
Nuspojave se osnovno dijele na nuspojave tipa A (posljedica pretjeranog farmakološkog učinka) i nuspojave tipa B, koje uključuju imunoalergijske reakcije, pseudoalergijske reakcije, metaboličku intoleranciju i idiosinkrazije. Od ukupno 6739 prijavljenih nuspojava, u 1973 slučaja može se govoriti o reakcijama tipa B, što čini 29% svih nuspojava, znatno više nego u 2012. godini.
U uzorku iz 2013. godine među osobama kod kojih se javljaju nuspojave tipa B dominiraju osobe ženskog spola. U 2% prijava spol nije poznat (Tablica 12.).
Broj prijava sumnji na nedjelotvornost lijekova (tip F) u 2013. godini iznosio je 2% ukupnog broja prijava. Uobičajeno nakon takvih prijava slijedi regulatorna akcija provjere kakvoće proizvoda na koji je takva nuspojava prijavljena.
Tablica 11. Vrste prijavljenih nuspojava u 2013. godini u usporedbi s podacima iz 2012. godine
| Vrsta nuspojava | Broj nuspojava u 2013. godini | Broj nuspojava u 2012. godini | % nuspojava u 2013. godini | % nuspojava u 2012. godini |
|---|---|---|---|---|
| Tip A | 4632 | 4386 | 69 | 84 |
| Tip B | 1973 | 718 | 29 | 14 |
| Tip F | 134 | 94 | 2 | 2 |
| UKUPNO: | 6739 | 5198 | 100 | 100 |
Tablica 12. Odnos spola i reakcija tipa B u 2013. godini u usporedbi s podacima iz 2012. godine
| Spol | Broj nuspojava tipa B u 2013. (2012.) godini | % u 2013. (2012.) godini |
|---|---|---|
| Muškarci | 629 (216) | 32 (30) |
| Žene | 1301 (482) | 66 (67) |
| Nepoznato | 43 (20) | 2 (3) |
| UKUPNO: | 1973 (718) | 100 |
Slika 15. Udio nuspojava tipa B po spolu bolesnika/korisnika lijekova u razdoblju od 2005. do 2013. godine
2.2.4. Broj lijekova u istovremenoj primjeni
Što se tiče odnosa dobi bolesnika i broja lijekova koje bolesnik istovremeno primjenjuje, u 2013. godini veći broj prijava sumnji na nuspojave cjepiva nije promijenio očekivanu sliku primjene lijekova u mlađih dobnih skupina gdje prevladava primjena samo jednog lijeka u terapiji odnosno prevenciji bolesti. Održan je trend prijava primjene većeg broja istodobno primijenjenih lijekova, posebno u starijim dobnim skupinama, što može biti objašnjenje većeg apsolutnog broja nuspojava zabilježenog u 2013. godini iako su ukupno one bile manje ozbiljne, kao što je objašnjeno u daljnjem tekstu (Tablica 13.).
Tablica 13. Dob bolesnika i broj lijekova koje bolesnik istovremeno primjenjuje
| Dob | 1 lijek | 2-3 lijeka | 4-5 lijekova | > 5 lijekova | Ukupno |
|---|---|---|---|---|---|
| Do 12 mjeseci | 25 | 6 | 0 | 1 | 32 |
| 1-2 godine | 30 | 4 | 0 | 0 | 34 |
| 3-6 godina | 59 | 4 | 3 | 1 | 67 |
| 7-14 godina | 85 | 17 | 2 | 1 | 105 |
| 15-17 godina | 23 | 11 | 1 | 0 | 35 |
| 18-40 godina | 206 | 105 | 32 | 9 | 352 |
| 41-64 godine | 292 | 263 | 154 | 72 | 781 |
| 65-74 godina | 118 | 150 | 119 | 64 | 451 |
| 75-84 godina | 47 | 71 | 91 | 60 | 269 |
| > 85 godina | 7 | 11 | 21 | 5 | 44 |
| Neupisano | 168 | 87 | 46 | 20 | 321 |
| UKUPNO: | 1060 | 729 | 469 | 233 | 2491 |
Slika 16. Udio prijava s 2-3 lijeka u istovremenoj primjeni po dobnim skupinama u odrasloj dobi u razdoblju od 2005. do 2013. godine
Slika 17. Udio prijava s 4-5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi u razdoblju od 2005. do 2013. godine
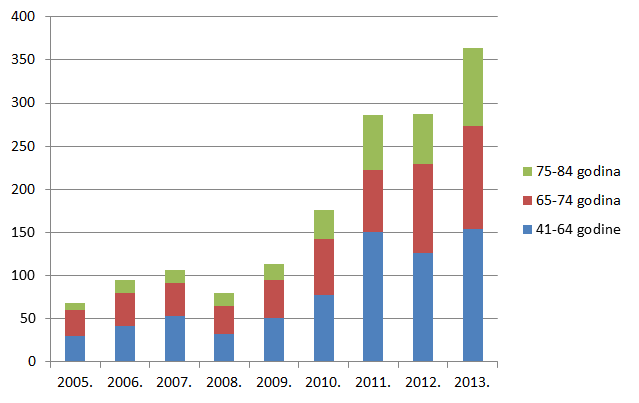
Slika 18. Udio prijava s više od 5 lijekova u istovremenoj primjeni po dobnim skupinama u odrasloj dobi u razdoblju od 2005. do 2013. godine
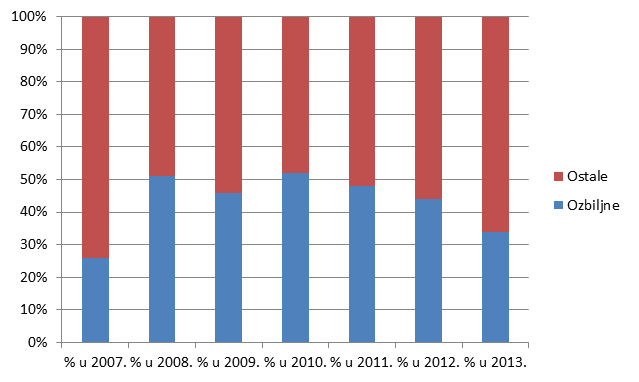
U 2013. godini broj nuspojava koje ne ispunjavaju niti jedan od kriterija za ozbiljnu nuspojavu značajno je veći od broja onih koji takve kriterije ispunjavaju (66% ne-ozbiljnih prema 34% ozbiljnih nuspojava).
Nuspojave koje zadovoljavaju najmanje jedan od navedenih kriterija smatraju se u regulatornom smislu ozbiljnima:
- ako se radi o medicinski značajnom stanju koje se može smatrati ozbiljnim
- ako je nuspojava uzrokovala hospitalizaciju (bolničko liječenje) ili produženje hospitalizacije
- ako je došlo do razvoja anomalije kod novorođenčeta zbog toga što je majka uzimala lijek tijekom trudnoće
- ako je nuspojava izazvala invalidnost ili trajnu nesposobnost
- ako nuspojava ugrožava život bolesnika/korisnika lijeka
- ako je nuspojava izazvala smrt osobe.
Razlozi za općenito niži udio ozbiljnih nuspojava među prijavljenim nuspojavama mogu se pronaći u sve većem broju prijava od strane farmaceuta te manjem broju prijava koje pristižu iz bolničkih centara.
Kao što se može vidjeti iz Tablice 14., broj prijava sumnji da je nuspojava određenog lijeka uzrokovala smrtni slučaj u 2013. godini niži je u odnosu na ranije godine.
Slika 19. Kretanje broja prijava prema ozbiljnosti u razdoblju od 2007. do 2013. godine
Tablica 14. Broj ozbiljnih nuspojava prijavljenih u 2013. godini u usporedbi s 2012. godinom sukladno kriterijima prema ICH smjernici E2A
| Kriterij | Broj prijava u 2013. godini | Broj prijava u 2012. godini |
|---|---|---|
| Smrt | 32 | 36 |
| Hospitalizacija | 275 | 302 |
| Invalidnost | 33 | 35 |
| Ugrožava život | 76 | 72 |
| Prirođena anomalija | 2 | 2 |
| Medicinski značajno ozbiljno stanje | 568 | 560 |
| UKUPNO: | 986* | 1007 |
*neke nuspojave ispunjavaju nekoliko kriterija ozbiljnosti pa je ukupan zbroj u tablici veći od ukupnog broja prijava ozbiljnih nuspojava
Tablica 15. Pregled ozbiljnih prijava prema tipu prijavitelja
| Kriterij | Liječnici | Farmaceuti | Pacijenti / korisnici / skrbnici | Ostali zdravstveni radnici |
|---|---|---|---|---|
| Broj ozbiljnih prijava | 559 (48%) | 139 (16%) | 62 (43%) | 64 (18%) |
| Ukupan prijava iz izvora | 1161 | 844 | 142 | 344 |
| Udio u ukupnom broju ozbiljnih nuspojava | 67% | 17% | 8% | 8% |
U Tablici 15. vidljivo je da se u 43% prijava od strane pacijenata radi o ozbiljnim prijavama, što je vrlo slično s 48% ozbiljnih nuspojava koje prijavljuju liječnici u odnosu na ukupan broj prijava koje kao skupina prijavljuju. Dodatnom statističkom analizom predstavljenom kroz tri tablice u nastavku Izvješća testirana su tri različita para prijavitelja kako bi se stekao bolji uvid u obrasce prijavljivanja ozbiljnih nuspojava pojedinih kategorija prijavitelja. Može se zaključiti da farmaceuti statistički značajno manje prijavljuju ozbiljne nuspojave u usporedbi s liječnicima i pacijentima. Vrlo zanimljiv i važan je nalaz kako nema statistički značajne razlike u prijavljivanju ozbiljnih nuspojava između pacijenata i liječnika!
Tablica 16. Liječnici-ljekarnici (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 142,536a | p < 0,05 |
Tablica 17. Ljekarnici-pacijenti (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 25,991a | p < 0,05 |
Tablica 18. Liječnici-pacijenti (Hi-kvadrat test)
| Vrijednost | Statistička značajnost | |
|---|---|---|
| Pearsonov Hi-kvadrat test | 4,392a | 0,111 |
U 2013. godini nije bilo velikih promjena prema zastupljenosti pojedinih vrsta ishoda nuspojava u odnosu na 2012. godinu, ali se, nažalost, nastavio povećavati broj prijava koje nemaju podatke o ishodu nuspojave. Razlog se može pronaći u visokom udjelu prijava od strane farmaceuta i nositelja odobrenja, čije prijave u pravilu ne sadrže ovaj podatak jer najčešće ne mogu doći do njega (Tablica 19). HALMED će putem dodatnih edukativnih aktivnosti pokušati poboljšati ovaj pokazatelj kvalitete prijava.
Sumnja da je smrtni ishod nastao kao posljedica nuspojave lijeka prijavljena je u 32 slučaja. Od navedene 32 prijave, u dva se slučaja radilo o samoubojstvu, a u dva o predoziranju lijekom u mlađih osoba. Navedeni slučajevi naglašavaju važnost primjerenog čuvanja lijeka i pridržavanja mjera minimizacije rizika koje prate pojedine lijekove. Važno je naglasiti kako se u najvećem broju smrtnih slučajeva za koje se sumnja da su povezani s lijekovima radi o bolesnicima s teškom osnovnom bolešću, što dodatno otežava procjenu povezanosti lijeka i nuspojave sa smrtnim ishodom.
Tablica 19. Udio nuspojava lijekova i cjepiva prijavljenih u 2013. godini s ishodom nuspojava u usporedbi s 2012. godinom
| Ishod nuspojave | 2013. | 2012. | % 2013. | % 2012. |
|---|---|---|---|---|
| Oporavak bez posljedica | 3678 | 2772 | 55 | 57 |
| Oporavak s posljedicama | 50 | 107 | 1 | 2 |
| U tijeku | 521 | 401 | 8 | 8 |
| Bez oporavka/Nepoznato | 2420 | 1544 | 36 | 32 |
2.2.7. Nuspojave po organskim sustavima
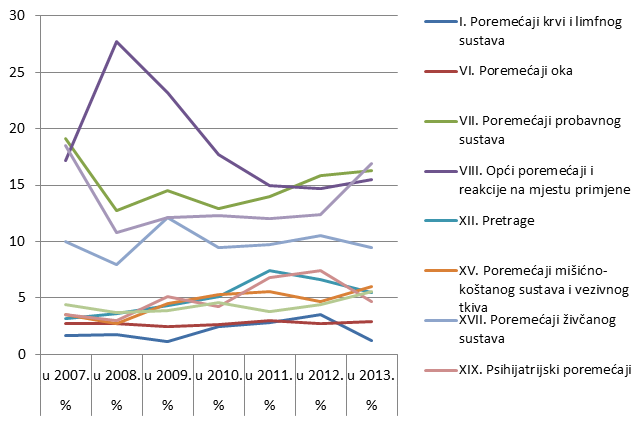
Nuspojave su navedene prema MedDRA-inoj klasifikaciji organskih sustava (MedDRA - Medical Dictionary for Regulatory Activities - Medicinski rječnik za regulatorne poslove), koja se koristi u kodiranju prijavljenih nuspojava i standard je za međunarodnu komunikaciju na tom polju. Najveći broj nuspojava zabilježen je za organske sustave (SOC) kao i prethodnih godina: najviše je nuspojava iz SOC-a Poremećaji kože i potkožnog tkiva s udjelom od gotovo 17% ukupnog broja prijava. Slijede Poremećaji probavnog sustava (16,3% u odnosu na 14% u 2012. godini) te Opći poremećaji i reakcije na mjestu primjene (15,5% u usporedbi s 15% u 2012. godini).
Tablica 20. Nuspojave po MedDRA-inoj klasifikaciji organskih sustava u 2013. godini
| Organski sustav (SOC) | Broj nuspojava u 2013. godini | Udio nuspojava u 2013. godini (%) |
|---|---|---|
| I. Poremećaji krvi i limfnog sustava | 83 | 1,2 |
| II. Srčani poremećaji | 105 | 1,6 |
| III. Prirođeni, obiteljski i genetski poremećaji | 1 | 0,0 |
| IV. Poremećaji uha i labirinta | 89 | 1,3 |
| V. Endokrini poremećaji | 29 | 0,4 |
| VI. Poremećaji oka | 197 | 2,9 |
| VII. Poremećaji probavnog sustava | 1098 | 16,3 |
| VIII. Opći poremećaji i reakcije na mjestu primjene | 1046 | 15,5 |
| IX. Poremećaji jetre i žuči | 41 | 0,6 |
| X. Poremećaji imunološkog sustava | 79 | 1,2 |
| XI. Infekcije i infestacije | 101 | 1,5 |
| XII. Pretrage | 374 | 5,5 |
| XII. Ozljede, trovanja i proceduralne komplikacije | 119 | 1,8 |
| XIV. Poremećaji metabolizma i prehrane | 83 | 1,2 |
| XV. Poremećaji mišićno-koštanog sustava i vezivnog tkiva | 403 | 6,0 |
| XVI. Dobroćudne, zloćudne i nespecificirane novotvorine | 23 | 0,3 |
| XVII. Poremećaji živčanog sustava | 639 | 9,5 |
| XVIII. Stanja vezana uz trudnoću, babinje i perinatalno razdoblje | 29 | 0,4 |
| XIX. Psihijatrijski poremećaji | 316 | 4,7 |
| XX. Poremećaji bubrega i mokraćnog sustava | 96 | 1,4 |
| XXI. Poremećaji reproduktivnog sustava i dojki | 97 | 1,4 |
| XXII. Poremećaji dišnog sustava, prsišta i sredoprsja | 378 | 5,6 |
| XXIII. Poremećaji kože i potkožnog tkiva | 1138 | 16,9 |
| XXIV. Socijalne okolnosti | 9 | 0,1 |
| XXV. Operativni i medicinski postupci | 28 | 0,4 |
| XXVI. Krvožilni poremećaji | 138 | 2,0 |
| UKUPNO: | 6739 | 100 |
Slika 20. Prikaz kretanja nuspojava iz najzastupljenijih organskih sustava u razdoblju od 2007. do 2013. godine
Tablica 21. Ukupni broj prijava klasificiranih po organskim sustavima (SOC) po prijaviteljima u 2013. godini
| Mjesto po broju prijava po SOC-u | Liječnici SOC | Farmaceuti | Pacijenti | |||
|---|---|---|---|---|---|---|
| SOC | Broj prijava | SOC | Broj prijava | SOC | Broj prijava | |
| 1. | VIII | 590 | XXIII | 237 | VIII | 88 |
| 2. | XXIII | 459 | VII | 192 | VII | 55 |
| 3. | VII | 388 | VIII | 147 | XVII | 50 |
Zanimljivo je promotriti za koje organske sustave stiže najviše prijava od strane liječnika, farmaceuta i pacijenata; liječnici najčešće prijavljuju nuspojave svrstane u SOC VIII. Opći poremećaji i reakcije na mjestu primjene. Kod liječnika su na drugom mjestu nuspojave iz SOC-a XXIII. Poremećaji kože i potkožnog tkiva, a na trećem mjestu SOC VII. Poremećaji probavnog sustava. Farmaceuti najčešće prijavljuju nuspojave iz SOC-a XXIII. Poremećaji kože i potkožnog tkiva, na drugom mjestu su nuspojave iz SOC-a VII. Poremećaji probavnog sustava te na trećem mjestu nuspojave iz SOC-a VIII. Opći poremećaji i reakcije na mjestu primjene. Pacijenti, kao i liječnici, najčešće prijavljuju nuspojave iz SOC-a VIII. Opći poremećaji i reakcija na mjestu primjene, na drugom mjestu su nuspojave iz SOC-a VII. Poremećaji probavnog sustava, a na trećem nuspojave iz SOC-a XVII. Poremećaji živčanog sustava.
2.2.8. Najčešće prijavljene nuspojave u 2013. godini
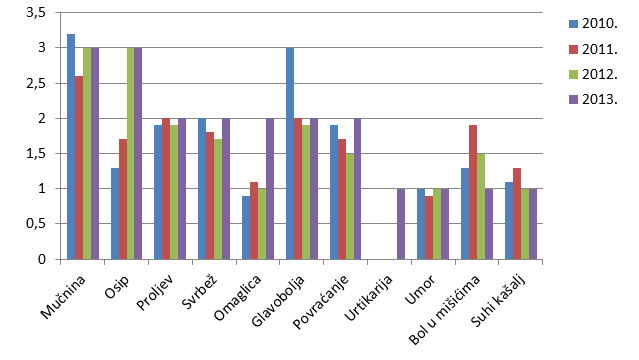
Kao i u prošlogodišnjem Izvješću, donosimo pregled najčešće prijavljenih nuspojava. U tablici su navedene samo one nuspojave koje su prijavljene više od 50 puta. U usporedbi s 2012. godinom, iste nuspojave zauzimaju prvih dvadesetak mjesta s nešto promijenjenim udjelom u ukupnom broju nuspojava. U 2013. godini najčešće su prijavljene nuspojave kao što su mučnina, osip, proljev, povraćanje, što su nuspojave karakteristične za klasične sintetske lijekove. Radi se o nuspojavama koje su prijaviteljima dobro uočljive, jasno vremenski povezane s uzimanje lijeka (najčešće nestaju nakon prestanka uzimanja lijeka), nerijetko bitno smanjuju kvalitetu života pacijenta iako regulatorno ne spadaju u ozbiljne nuspojave. S druge strane, u praksi dio simptoma ne biva prepoznat kao nuspojava lijeka već se dijagnosticira kao "nova bolest" (hipertenzija, kardiovaskularni incidenti, prijelom kostiju, razvoj depresije). Najčešće se radi o nuspojavama koje se javljaju kod dugotrajne primjene lijeka ili kombinacije lijekova pa izostaje jasna vremenska povezanost. Kod takvih primjera nuspojava primjenjuju se druge strategije utvrđivanja eventualne povezanosti lijeka i nuspojave kao što su farmakoepidemiološke studije.
Tablica 22. Najčešće prijavljene nuspojave u 2013. godini
| Nuspojava | Broj prijava u 2013. godini |
|---|---|
| Mučnina | 215 |
| Osip | 192 |
| Proljev | 153 |
| Svrbež | 142 |
| Omaglica | 135 |
| Glavobolja | 134 |
| Povraćanje | 122 |
| Urtikarija | 85 |
| Umor | 68 |
| Bol u mišićima | 56 |
| Suhi kašalj | 50 |
Slika 21. Grafički prikaz udjela najčešće prijavljenih nuspojava u odnosu na ukupan broj prijavljenih nuspojava u 2012., 2011. i 2010. godini
3. Pregled sigurnosnih pitanja u 2013. godini
3.1. Pregled najvažnijih sigurnosnih regulatornih mjera poduzetih u 2013. godini
3.1.1. Kombinirani hormonski kontraceptivi treće i četvrte generacije
Tijekom 2013. godine, na razini Europske unije provedena je procjena kombiniranih hormonskih kontraceptiva treće i četvrte generacije (tzv. "noviji" kombinirani hormonski kontraceptivi). Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene kombiniranih hormonskih kontraceptiva, s osobitom pozornošću usmjerenom na od ranije poznati rizik od nastanka krvnih ugrušaka u venama koji je povezan s primjenom ovih lijekova (venska tromboembolija, VTE). VTE se u žena koje ne koriste kombinirane hormonske kontraceptive i koje nisu trudne javlja u otprilike 2 slučaja svake godine na 10.000 žena.
Kombinirani hormonski kontraceptivi (KHK) su učinkoviti lijekovi koji se koriste za sprječavanje neplanirane trudnoće. Ovi lijekovi sadrže dva hormona: estrogen i progestagen. Estrogen koji sadrži većina lijekova naziva se etinilestradiol, ali neki lijekovi sadrže drugi estrogen koji se naziva estradiol. Dostupan je veliki broj progestagena.
Navedena ocjena potvrdila je kako je ukupni rizik nastanka venske tromboembolije povezan s primjenom svih kombiniranih hormonskih kontraceptiva malen. Za usporedbu, broj slučajeva VTE tijekom godine dana korištenja bilo kojeg KHK-a je manji od broja slučajeva koji se javljaju u žena tijekom trudnoće i postpartalnog razdoblja (babinje). Ne postoji razlog da žene koje su do sada uzimale KHK bez nuspojava prestanu uzimati lijekove iz ove skupine. Dokazano je da je rizik od VTE-a najveći tijekom prve godine u kojoj žena počne uzimati hormonalne kontraceptive ili kada ponovno počne uzimati ove lijekove nakon stanke u primjeni od najmanje mjesec dana. Nakon početnog povišenog rizika tijekom prve godine primjene, rizik se smanjuje na kontinuirano nisku razinu.
Postoji mala razlika u riziku primjene lijekova iz ove skupine, ovisno o vrsti progestagena koji sadrže. Kombinirani hormonski kontraceptivi koji sadrže etinilestradiol i jedan od sljedećih progestagena: levonorgestrel, norgestimat ili noretisteron imaju rizik koji je manji u usporedbi s lijekovima iz ove skupine koji sadrže druge progestagene.
Najniži rizik za nastanak VTE-a imaju KHK-i koji sadrže progestogene levonogestrel (Adexa, Leona i Tiquilar), norgestimat (Cilest) i noretisteron (Trinovom): 5 - 7 slučajeva na 10.000 žena u godini dana. Rizik je viši s KHK-ima koji sadrže progestogene etonogestrel (Nuvaring) i norelgestromin (Evra): 6 - 12 slučajeva na 10.000 žena u godini dana. Rizik je također viši s KHK-ima koji sadrže progestogene gestoden (Lindynette, Logest, Naelia i Yvon), desogestrel (Novynette), drospirenon (Yasmin, Yaz, Linatera, Palandra, Rosanelle, Rosanne, Softine, Softinelle): 9 - 12 slučajeva na 10.000 žena u godini dana. Za KHK-e koji sadrže progestogene klormadinon (Belara, Estal), dienogest (Qlaira, Donella) i nomegestrol (Zoely i Ioa) dostupni podaci su nedovoljni za procjenu rizika u odnosu na ostale KHK-e, ali nove studije su planirane ili su u tijeku.
Riziku od nastanka venske tromboembolije podložnije su žene u kojih su prisutni rizični faktori koji uključuju pušenje, prekomjernu težinu, dob, migrene, VTE u obiteljskoj anamnezi i porod nekoliko tjedana prije početka primjene kombiniranog hormonskog kontraceptiva. Izuzetno je važno da korisnice i propisivači budno paze na znakove i simptome tromboembolije koji mogu uključivati jaku bol ili otekline nogu, nagli neobjašnjivi gubitak daha, ubrzano disanje ili kašalj, bol u prsima, slabost ili utrnulost lica, ruku ili nogu. U slučaju da pacijentica razvije bilo koji od navedenih znakova ili simptoma, treba odmah potražiti liječničku pomoć.
S obzirom na to da se rizični faktori u pojedine pacijentice mijenjaju tijekom vremena, liječnici rizik od nastanka VTE za svaku individualnu pacijenticu moraju procijeniti prilikom propisivanja KHK-a i periodički ponovno ocjenjivati tijekom nastavka terapije.
Zbog navedenoga sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažetci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile nove informacije. Na internetskim stranicama HALMED-a, u dijelu Za pacijente, objavljene su informacije za pacijentice u obliku pitanja i odgovora o primjeni kombiniranih hormonskih kontraceptiva.
3.1.2. Lijekovi koji sadrže ciproteronacetat i etinilestradiol
Tijekom 2013. godine, na razini Europske unije provedena je procjena lijekova koji sadrže ciproteronacetat i etinilestradiol. Osobita pozornost u ocjeni primjene ovih lijekova bila je usmjerena na od ranije poznati rizik od nastanka krvnih ugrušaka.
Ovi lijekovi su široko primjenjivani diljem Europe te su do ove procjene u nekim zemljama bili odobreni samo za liječenje akni, dok su u ostalim zemljama EU bili odobreni i za liječenje akni u žena koje žele uzimati oralnu kontracepciju, kao i za liječenje drugih kožnih bolesti.
Nakon provedene procjene, zaključeno je da se ovi lijekovi smiju koristiti isključivo u liječenju umjerenih do teških oblika akni povezanih s androgenizacijom i/ili hirzutizmom (prekomjerni rast dlaka na licu) u žena reproduktivne dobi. Liječenje ovim lijekovima smije se započeti tek kad se druge vrste liječenja, poput lokalnog liječenja i oralne primjene antibiotika, pokažu neuspješnima. S obzirom na to da ovi lijekovi imaju kontraceptivni učinak, ne smiju se koristiti u kombinaciji s drugim hormonskim kontraceptivima. Rizik od nastanka krvnih ugrušaka u venama uz ove lijekove je sličan riziku uz kontraceptive koji sadrže gestoden, desogestrel ili drospirenon. Stoga je važno da pacijentice i propisivači budno paze na znakove i simptome nastanka tromboembolije. U slučaju da pacijentica razvije bilo koji od znakova ili simptoma tromboembolije, treba odmah potražiti liječničku pomoć.
Informacije u sažetcima opisa svojstava lijeka i uputama o lijeku za lijekove odobrene za stavljanje u promet u Republici Hrvatskoj koji sadrže ciproteronacetat i etinilestradiol već su od ranije sadržavale ograničenja primjene ovih lijekova koja su u skladu s novim europskim preporukama. Zbog toga su nakon provedene europske procjene navedeni dokumenti samo minimalno izmijenjeni, kako bi bili u potpunosti u skladu s europskim preporukama, a javnost je informirana putem internetskih stranica HALMED-a.
3.1.3. Lijekovi za sistemsku primjenu koji sadrže diklofenak
Tijekom 2013. godine, na razini Europske unije provedena je procjena lijekova za sistemsku primjenu koji sadrže diklofenak. Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene ovih lijekova, s osobitom pozornošću usmjerenom na od ranije poznati rizik od nastanka krvnih ugrušaka u arterijama, što može dovesti do srčanog ili moždanog udara.
Zbog svojeg analgetskog i protuupalnog učinka ovi su lijekovi široko primjenjivani diljem Europe, pri čemu se kratkoročno primjenjuju u liječenju bolnih stanja, dok se dugoročno obično primjenjuju radi ublažavanja simptoma reumatskih bolesti.
Nakon provedene procjene, zaključeno je da koristi primjene diklofenaka i dalje nadmašuju rizike. Međutim, ocijenjeno je da postoji mali rizik od srčanog ili moždanog udara u bolesnika koji ove lijekove uzimaju redovito, osobito ako lijek uzimaju dugoročno i u visokoj dozi (150 mg dnevno). Kardiovaskularni rizik diklofenaka sličan je riziku druge skupine analgetika, koji se nazivaju selektivnim COX-2 inhibitorima, te su od sada za primjenu diklofenaka uvedena jednaka ograničenja kao i za COX-2 inhibitore. Stoga se lijekovi za sistemsku primjenu koji sadrže diklofenak ne smiju više primjenjivati u bolesnika koji su preboljeli srčani ili moždani udar, koji imaju zatajenje srca, ishemijsku bolest srca, perifernu arterijsku bolest ili cerebrovaskularnu bolest. U bolesnika koji imaju rizične faktore za kardiovaskularne događaje kao što su hipertenzija, hiperlipidemija, šećerna bolest i pušenje, liječenje diklofenakom smije se započeti samo nakon pažljive procjene. U svih bolesnika liječenje diklofenakom treba provesti primjenom najmanje učinkovite doze u najkraćem mogućem vremenu potrebnom za kontrolu simptoma.
Zbog navedenoga sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su sažetci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova izmijenjeni kako bi se uvrstile nove informacije.
3.1.4. Otopine za infuziju koje sadrže hidroksietil škrob (HES)
Tijekom 2013. godine, na razini Europske unije provedena je procjena otopina za infuziju koje sadrže hidroksietil škrob (HES). Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene ovih lijekova, s osobitom pozornošću usmjerenom na rizike od oštećenja bubrega koje zahtijeva dijalizu i od smrtnosti u određenih skupina bolesnika.
Otopine za infuziju koje sadrže HES pripadaju skupini lijekova poznatoj pod nazivom koloidi i primjenjuju se za nadomještanje volumena krvi.
Nakon provedene procjene, zaključeno je da se, zbog rizika od oštećenja bubrega i od mortaliteta, ovi lijekovi više ne smiju primjenjivati u bolesnika sa sepsom (bakterijskom infekcijom krvi), opeklinama ili u bolesnika u kritičnom stanju. Otopine za infuziju koje sadrže HES mogu se i dalje primjenjivati za liječenje hipovolemije (smanjeni volumen krvi) uzrokovane akutnim gubitkom krvi kada se primjena samo kristaloida ne smatra dostatnom. Nakon primjene lijeka potrebno je nadzirati funkciju bubrega, a lijek se treba primjenjivati u najnižoj mogućoj dozi i u najkraćem vremenskom roku.
Zbog navedenoga sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni sažetci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile nove informacije. Nadalje, bit će provedene dodatne studije o primjeni ovih lijekova tijekom elektivnih operacija i u bolesnika u traumi.
3.1.5. Lijekovi koji sadrže kalcitonin
Tijekom 2013. godine, na razini Europske unije provedena je procjena lijekova koji sadrže kalcitonin. Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene ovih lijekova, s osobitom pozornošću usmjerenom na rizik od nastanka karcinoma koji je uočen pri dugoročnoj primjeni ovih lijekova.
Kalcitonin je hormon koji povećava količinu kalcija u kostima i snižava razinu kalcija u krvi, a bio je primjenjivan u liječenju osteoporoze, Pagetove bolesti (bolest koja zahvaća pregradnju kostiju i može dovesti do nastanka deformiteta), hiperkalcemije (povišene razine kalcija u krvi) zbog raka i za sprečavanje akutnog gubitka koštane mase zbog nagle imobilizacije. Ovi lijekovi bili su dostupni u obliku spreja za nos te u obliku otopina za injekciju i infuziju.
Nakon provedene procjene, zaključeno je da je omjer koristi i rizika kalcitonina u obliku spreja za nos namijenjenog dugoročnom liječenju osteoporoze negativan, uzevši u obzir ograničenu djelotvornost kalcitonina u liječenju osteoporoze. Zbog toga su u cijeloj Europi ukinuta odobrenja ovih lijekova te su oni povučeni iz prometa. Za kalcitonin u obliku otopine za injekciju i infuziju je ocijenjeno da korist primjene nadmašuje rizike u ograničenoj skupini bolesnika. Stoga se ovaj farmaceutski oblik smije koristiti samo za sprječavanje akutnog gubitka koštane mase zbog iznenadne imobilizacije, liječenje Pagetove bolesti u bolesnika koji ne reagiraju na drugo liječenje ili za koje drugo liječenje nije primjereno i za liječenje hiperkalcemije uzrokovane rakom. Liječenje kalcitoninom mora biti ograničeno na najkraće moguće vrijeme i na najmanju učinkovitu dozu.
Zbog navedenoga sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te je ukinuto odobrenje za stavljanje u promet kalcitonina u obliku spreja za nos.
3.1.6. Lijekovi koji sadrže stroncijev ranelat
Tijekom 2013. godine, na razini Europske unije provedena je procjena lijekova koji sadrže stroncijev ranelat. Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene ovih lijekova, s osobitom pozornošću usmjerenom na rizik od kardiovaskularnih nuspojava, uključujući srčani udar. Lijekovi koji sadrže stroncijev ranelat koriste se u liječenju osteoporoze.
Nakon provedene procjene kardiovaskularnih rizika ovih lijekova, zaključeno je da omjer koristi i rizika ostaje pozitivan u ograničenoj populaciji bolesnika. Zbog toga je 2013. godine primjena ovih lijekova ograničena na liječenje teške osteoporoze kod žena u postmenopauzi s visokim rizikom od prijeloma i kod muškaraca s visokim rizikom od prijeloma. Dodatno, ovi lijekovi ne smiju se primijeniti kod bolesnika s ishemijskom bolesti srca, perifernom arterijskom bolesti, cerebrovaskularnom bolesti ili anamnezom ovih bolesti te u bolesnika s nekontroliranom hipertenzijom. Liječenje ovim lijekovima smije započeti samo liječnik s iskustvom u liječenju osteoporoze, a odluka o propisivanju stroncijevog ranelata mora se temeljiti na pažljivoj individualnoj procjeni ukupnog rizika svakog bolesnika. Liječnici koji propisuju lijek trebaju procijeniti rizik za razvoj kardiovaskularnih bolesti prije početka liječenja i u redovitim intervalima tijekom liječenja za svakog bolesnika. Bolesnike sa značajnim rizikom za razvoj kardiovaskularnih događaja (npr. bolesnici s hipertenzijom, hiperlipidemijom, dijabetesom, pušači) smije se liječiti ovim lijekovima samo nakon pažljive individualne procjene rizika. Liječenje ovim lijekovima mora se prekinuti ako bolesnik razvije ishemijsku bolest srca, perifernu arterijsku bolest, cerebrovaskularnu bolest ili ako ima nekontroliranu hipertenziju.
Osim detaljnih informacija o kardiovaskularnim nuspojavama, razmotreni su i drugi rizici koji su povezani s primjenom ovih lijekova, što uključuje ozbiljne kožne nuspojave, poremećaje svijesti, napadaje, hepatitis (upala jetre) i smanjenje broja krvnih stanica. Nakon ove cjelovite procjene, početkom 2014. godine zaključeno je da je indikaciju navedenih lijekova potrebno dodatno ograničiti te je njihova primjena sada moguća samo u onih bolesnika kod kojih liječenje drugim lijekovima odobrenim u liječenju osteoporoze nije moguće zbog, primjerice, kontraindikacije ili nepodnošenja.
Zbog navedenoga sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a te su izmijenjeni a sažetci opisa svojstava lijeka i upute o lijeku odgovarajućih lijekova kako bi se uvrstile nove informacije. Za zdravstvene radnike i bolesnike bit će pripremljeni edukacijski materijali vezani uz sadašnju indikaciju i ograničenja primjene ovih lijekova.
3.1.7. Lijekovi za oralnu primjenu koji sadrže ketokonazol
Tijekom 2013. godine, na razini Europske unije provedena je procjena lijekova za oralnu primjenu (primjena na usta) koji sadrže ketokonazol. Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene ovih lijekova, s osobitom pozornošću usmjerenom na od ranije poznati rizik od oštećenja jetre.
Ketokonazol je lijek koji se koristi u liječenju gljivičnih infekcija, a u zemljama Europske unije odobren je od 1980. godine.
Nakon provedene procjene, zaključeno je da koristi lijekova za oralnu primjenu koji sadrže ketokonazol u liječenju gljivičnih infekcija više ne nadmašuju rizike, zbog podataka koji ukazuju na veću toksičnost za jetru ovog lijeka u odnosu na druge lijekove koji se koriste za liječenje gljivičnih infekcija. Dodatno, nije bilo moguće identificirati mjere kojima bi se ovaj rizik mogao primjereno umanjiti. Nadalje, podaci o učinkovitosti lijekova za oralnu primjenu koji sadrže ketokonazol ograničeni su i ne zadovoljavaju važeće standarde, a dostupne su zamjenske vrste liječenja. Navedeno se ne odnosi na farmaceutske oblike ketokonazola koji se primjenjuju lokalno (kao što su kreme, masti i šamponi), s obzirom na to da je količina ketokonazola koji se apsorbira u tijelo kod primjene ovih oblika vrlo niska stoga takvi lijekovi ostaju i dalje u primjeni.
Nakon što je navedena procjena provedena, u Republici Hrvatskoj nije bilo odobrenih oralnih oblika ketokonazola za koje bi bilo potrebno ukinuti odobrenje za stavljanje u promet. O navedenom sigurnosnom pitanju javnost je informirana putem internetskih stranica HALMED-a.
3.1.8. Kratkodjelujući beta-agonisti
Tijekom 2013. godine, na razini Europske unije provedena je procjena primjene lijekova iz skupine kratkodjelujućih beta-agonista u opstetričkim indikacijama. Postupak je uključivao sveobuhvatnu ocjenu omjera koristi i rizika primjene ovih lijekova u opstetričkim indikacijama, s osobitom pozornošću usmjerenom na od ranije poznate rizike od srčanih i krvožilnih nuspojava. Djelatne tvari na koje se odnosila navedena procjena su terbutalin, salbutamol, heksoprenalin, ritodrin, fenoterol i izoksuprin. Ocjena sigurnosti primjene odnosila se samo na opstetričke indikacije i nije obuhvaćala ostale indikacije u kojima se navedeni lijekovi primjenjuju.
Kratkodjelujući beta-agonisti su lijekovi koje se zbog učinka opuštanja glatkih mišića koristi prvenstveno u liječenju reverzibilne opstrukcije dišnih putova, primjerice u astmi. Neki od ovih lijekova su u zemljama Europske unije odobreni za sprečavanje prijevremenih trudova ili poroda zbog učinka na opuštanje glatkih mišića maternice (opstetričke indikacije).
Nakon provedene procjene, zaključeno je da koristi oralnih oblika kratkodjelujućih beta-agonista u opstetričkim indikacijama više ne nadmašuju rizike od srčanih i krvožilnih nuspojava. Kratkodjelujući beta-agonisti povezani su s ozbiljnim i o dozi ovisnim nuspojavama, uglavnom kardiovaskularne prirode, koje su primijećene i kod majke i kod fetusa. Ne postoje dostatni podaci koji idu u prilog primjeni oralnih beta-agonista za prevenciju prijevremenog porođaja kod žena s visokim rizikom od prijevremenih trudova. Nije primijećen statistički značajan učinak tokolize na perinatalni mortalitet ili morbiditet u randomiziranim, kontroliranim ispitivanjima. Zbog navedenog, kratkodjelujući beta-agonisti u oralnom obliku više se ne smiju primjenjivati ni u jednoj opstetričkoj indikaciji. Primjena parenteralnih (koji se primjerice primjenjuju u venu) kratkodjelujućih beta-agonista ograničena je na najviše 48 sati, a pod nadzorom specijalista smije ih se primjenjivati za sprječavanje prijevremenih trudova između 22. i 37. tjedna trudnoće i za opuštanje maternice prije procedura, npr. kod vanjskog okreta fetusa iz položaja na zadak. Parentalni kratkodjelujući beta-agonisti se ne smiju primjenjivati kod žena s anamnezom bolesti srca, ili u stanjima majke ili fetusa pri kojima se produljenje trudnoće smatra rizičnim.
Od djelatnih tvari obuhvaćenih navedenom sigurnosnom ocjenom, u Republici Hrvatskoj su nakon završetka ocjene postojali za opstetričke indikacije odobreni jedino lijekovi čija je djelatna tvar fenoterol. Zbog navedenoga sigurnosnog pitanja upućeno je pismo zdravstvenim radnicima, javnost je informirana putem internetskih stranica HALMED-a, sažetak opisa svojstava lijeka i upute o lijeku odgovarajućeg lijeka za parenteralnu primjenu izmijenjeni su kako bi se uvrstile nove informacije te je zbog navedenih sigurnosnih razloga ukinuto odobrenje za stavljanje u promet oralnog oblika lijeka.
3.2. Pregled ostalih pitanja vezanih uz sigurnost primjene lijekova u 2013. godini
3.2.1. Novosti u prijavljivanju nuspojava i regulatornim aktivnostima vezanim uz sigurnost primjene lijekova nakon ulaska Republike Hrvatske u Europsku uniju
Ulaskom Republike Hrvatske u Europsku uniju na snagu su stupili novi Zakon o lijekovima (Narodne novine, br. 76/13.) i pripadajući pravilnici, uključujući i Pravilnik o farmakovigilanciji (Narodne novine, br. 83/13.). Navedenim propisima su u pravni poredak Republike Hrvatske prenesene sve odgovarajuće direktive i uredbe Europske unije koje se odnose na lijekove i sigurnost njihove primjene. O HALMED-ovom zadovoljavanju zakonskih zahtjeva EU-a na području farmakovigilancije u rujnu 2013. godine podnesen je Izvještaj Europskoj komisiji temeljem provedenog unutarnjeg nadzora farmakovigilancijskog sustava HALMED-a. Izvještaj je javno objavljen na internetskim stranicama HALMED-a.
Najznačajnija izmjena u zakonodavstvu vezana uz obvezu prijavljivanja nuspojava od strane zdravstvenih radnika jest nova definicija nuspojave koja je u skladu s europskim propisima uvrštena u Zakon i Pravilnik. Prema novoj definiciji, nuspojava je svaka štetna i neželjena reakcija na primjenu lijeka. Navedeno uključuje nuspojave koje nastaju uz primjenu lijeka unutar odobrenih uvjeta, ali i nuspojave koje nastaju uz primjenu lijeka izvan odobrenih uvjeta (uključujući predoziranje, off-label primjenu, pogrešnu primjenu, zlouporabu i medikacijske pogreške), kao i nuspojave koje nastaju zbog profesionalne izloženosti lijeku.
Najznačajnija izmjena u stručnom regulatornom radu HALMED-a vezana uz donošenje regulatornih odluka zbog sigurnosnih pitanja povezanih s primjenom lijekova jest uključivanje HALMED-a u sustav donošenja odluka na razini EU. Naime, nacionalna regulatorna tijela država članica EU obvezna su zajednički, a ne jednostrano, donositi preporuke o važnim sigurnosnim pitanjima koja mogu dovesti do, primjerice, ograničavanja indikacije nekog lijeka, uvođenja kontraindikacije ili upozorenja te u iznimnim slučajevima i do ukidanja odobrenja za stavljanje lijeka u promet. Zajedničke preporuke donose se kroz rad u radnim tijelima Europske agencije za lijekove (EMA) kroz tzv. arbitražne postupke. Preporuke o sigurnosti primjene lijekova u najvećem broju slučajeva donosi Povjerenstvo za ocjenu rizika na području farmakovigilancije (PRAC) EMA-e. Pravno obvezujuće odluke za zemlje članice EU, ovisno o načinu na koji su odobreni lijekovi za koje se procjenjuje neko sigurnosno pitanje, donosi ili Europska komisija ili Koordinacijska grupa za postupak međusobnog priznavanja i decentralizirani postupak za humane lijekove (CMDh), regulatorno tijelo koje predstavlja zemlje članice EU.
S ciljem unapređenja sigurnosti primjene lijekova i razvoja odgovarajućih stručnih kompetencija za sudjelovanje u europskim postupcima ocjene sigurnosti primjene lijekova, HALMED je krajem 2012. godine osnovao Povjerenstvo za sigurnost primjene lijekova. Povjerenstvo je stručno tijelo HALMED-a koje obavlja poslove u svezi sa sigurnošću primjene lijekova sukladno propisima u području lijekova i farmakovigilancije. Povjerenstvo je stručno, neovisno i samostalno u okviru svojeg područja djelovanja, a informacije o članovima i rasporedu sjednica dostupne su na internetskim stranicama HALMED-a. Prva sjednica Povjerenstva održana je 19. prosinca 2012. godine, a tijekom 2013. godine održano je šest sjednica. U radu Povjerenstva u prvoj godini rada sudjelovala su 23 vanjska suradnika i 9 djelatnika HALMED-a. U slučajevima u kojima su radi ocjene pojedinih predmeta bila potrebna znanja izvan ekspertize stalnih članova, dodatno je u rad Povjerenstva bilo uključeno 7 vanjskih suradnika koji nisu članovi Povjerenstva. dok je radi ocjene pojedinih predmeta dodatno bilo uključeno 7 vanjskih suradnika koji nisu članovi Povjerenstva kada su bila potrebna znanja izvan ekspertize stalnih članova Povjerenstva. U prvoj godini rada Povjerenstvo je dalo mišljenje o 21 predmetu od kojih se najveći dio odnosio na arbitražne postupke pri EMA-i, a ostatak na ocjenu sigurnosnih signala i mjera minimizacije rizika. Osim ocjene navedenih sigurnosnih pitanja, zadaće Povjerenstva su i poticanje spontanog prijavljivanja nuspojava, aktivno promoviranje provođenja mjera minimizacije rizika i promoviranje sigurne i racionalne primjene lijekova.
3.2.2. Javna edukativna kampanja za promicanje važnosti čitanja upute o lijeku i prijavljivanja nuspojava na lijekove
HALMED je tijekom rujna i listopada 2013. godine proveo javnu edukativnu kampanju kojom se među pacijentima i korisnicima lijekova promicala važnost čitanja uputa o lijeku i prijavljivanja nuspojava. Kampanjom se građane željelo upoznati da, uz informacije koje dobivaju od kvalificiranih zdravstvenih radnika, dodatne informacije mogu dobiti čitanjem upute o lijeku, ali i aktivno se uključiti u liječenje i praćenje sigurnosti primjene lijekova prijavljivanjem nuspojava na lijekove. Takvim pristupom doprinosi se daljnjem unapređenju sigurnosti primjene lijekova te učinkovitoj zaštiti zdravlja pacijenata i poboljšanju javnog zdravlja. Prijave nuspojava sadrže iznimno važne informacije koje HALMED-u koriste u kontinuiranoj procjeni sigurnosti primjene lijeka tijekom cijelog njegovog životnog ciklusa, odnosno razdoblja u kojem se nalazi na tržištu. Svaki pacijent može prijavljivanjem nuspojava izravno doprinijeti unapređenju sigurnosti primjene lijekova za svakoga.
Provedena kampanja polučila je izniman uspjeh jer je dovela do trostrukog porasta broja prijava nuspojava zaprimljenih od pacijenata. Ukupan broj prijava nuspojava zaprimljenih tijekom 2013. godine bio je 142, dok je broj prijava od pacijenata u 2012. godini iznosio 45. Osim aktivnog pristupa bolesnika liječenju i praćenju sigurnosti primjene lijekova, kampanja je polučila i dodatna dva vrlo značajna uspjeha. Prvi je porast broja prijava nuspojava od strane zdravstvenih radnika, dok se drugi odnosi na cjelovitiji pristup medija izvještavanju o pitanjima koja se odnose na sigurnost primjene lijekova.
Javna edukativna kampanja dio je kontinuiranog rada HALMED-a na podizanju svijesti o sigurnosti primjene lijekova i na poticanju prijavljivanja sumnji na nuspojave lijekova i cjepiva. Više od polovice prijava sumnji na nuspojavu koje su tijekom 2013. godine zaprimljene od pacijenata pristigle su putem on-line aplikacije za prijavljivanje nuspojava, koja je dostupna na internetskim stranicama HALMED-a. Aplikacijom se pacijentima omogućuje aktivno i jednostavno sudjelovanje u praćenju sigurnosti primjene lijekova. Riječ je o aplikaciji za prijavljivanje nuspojava koju je razvio Uppsala Monitoring Centre, suradni centar Svjetske zdravstvene organizacije, a HALMED je kao prva država u svijetu aplikaciju pustio u rad u kolovozu 2012. godine. Porast broja prijava sumnji na nuspojave koje HALMED zaprima od pacijenata izniman je uspjeh koji pokazuje da su pacijenti prepoznali svoju ulogu i značaj u praćenju sigurnosti primjene lijekova.
Slika 22. Javnom edukativnom kampanjom HALMED je pozvao pacijente da prijave nuspojave na lijekove

Slika 23. Kampanjom HALMED-a je pacijentima naglašena i važnost čitanja upute o lijeku

4. Zaključak
Godina 2013. bila je obilježena rezultatima aktivne kampanje kojom se pacijenti pozivaju da izravno HALMED-u prijave sumnje na nuspojave lijekova. Nakon kampanje značajno je porastao broj prijava od ove skupine prijavljivača, koji je po dosadašnjim podacima već nekoliko mjeseci značajno visok. Vrijednost ovih prijava u ukupnom sustavu stalno se procjenjuje i prvi podaci pokazuju da pacijenti u jednakom omjeru prijavljuju ozbiljne nuspojave kao što to čine liječnici, a opis prijava je iscrpniji nego što je to u zdravstvenih radnika koji najčešće nuspojavu prijavljuju u jednoj dijagnozi. Ovakvim dodatnim podacima može se dodatno ocijeniti i kvaliteta života s lijekovima koje pacijenti uzimaju za svoju osnovnu bolest. Izravno prijavljivanje nuspojava HALMED-u od strane pacijenata ne zamjenjuje konzultaciju s liječnikom i/ili ljekarnikom te savjetovanje u vezi daljnje terapije.
Svake godine sve veći udio prijavljivača dolazi od strane farmaceuta, čije smo dodatno prijavljivanje primijetili i nakon početka kampanje o prijavljivanju nuspojava. Iako je kampanja prvenstveno bila namijenjena pacijentima, s obzirom na to da se većinom provodila putem distribucije edukativnih letaka i brošura u ljekarnama, i svijest o prijavljivanju nuspojava je bila veća i kod ove skupine zdravstvenih radnika. Ovakav visok postotak prijavljivača od strane farmaceuta u Europi zabilježen je još samo u skandinavskim zemljama, što ukazuje na važnost ovog vida zdravstvenog djelovanja naših ljekarnika jer se njime pokrivaju prijave na lijekove koji se izdaju bez recepta, a što doprinosi značajno kvalitetnijem praćenju sigurnosnog profila ove vrste lijekova.
Broj prijava iz bolnica i dalje nije zadovoljavajući te će HALMED nastaviti raditi na promicanju prijavljivanja ozbiljnih nuspojava iz bolničkih ustanova, posebno razvojem informatičke aplikacije za bolničke ustanove, čime će se omogućiti lakše prijavljivanje Agenciji.
Ulaskom u Europsku uniju, nuspojave koje su prijavljene i analizirane iz Republike Hrvatske postaju i sastavnim dijelom europske baze nuspojava - EudraVigilance, čiji su signali osnova za daljnju sigurnosnu analizu lijekova na temelju kojih se provode arbitražni postupci za pojedine lijekove i djelatne tvari u smislu poboljšanja sigurnosnih informacija o njima, ukidanjem određenih indikacija ili uvođenjem kontraindikacija, a u pojedinim slučajevima i povlačenjem lijekova s tržišta.
Svaka spontana prijava važna je za stalnu sigurnosnu procjenu lijeka i cjepiva te naglašavamo važnost prijava svake sumnje na nuspojavu lijekova i cjepiva kako od strane zdravstvenih radnika, tako i od strane pacijenata - korisnika lijeka.
Hrvatska je među najuspješnijim zemljama svijeta u ovom području, ali i dalje nastojimo unaprijediti sustav na način da pacijentu lijekovi budu dostupni na najsigurniji način. Samo zajedničkim nastojanjima to možemo i postići!





